微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
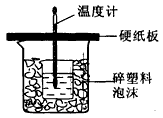
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”.“偏小’.“无影响”)
(3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热的数值会________(填“相等”或 “不相等”)。
参考答案:
(1)环形玻璃搅拌棒;保温、隔热,减少实验过程中的热最
本题解析:
本题难度:一般
2、填空题 在量热计(如下图所示)中将l00cm3、0. 500mol·L-1 CH3COOH溶液与100cm3、0. 500mol·L-1 NaOH溶液混合,温度从298.16K升高到300. 71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150. 5J·K-1,CH3COONa溶液比热容为4.03J·g-1·K-1,溶液的密度为0. 963g·cm-3。
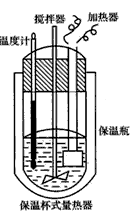
(1)试求CH3COOH的中和反应的反应热△H为____kJ·mol-1。
(2)CH3COOH的中和热的文献值为56. 1kJ·mol-1,请你分析(1)中测得的实验值偏差的可能原因是____。
(3)已知HCl( aq) +NaOH (aq)=NaCl(aq) +H2O(l) △H=- 57. 3kJ.mol-1;现有①CH3COOH、②浓H2SO4、
③HNO3与NaOH溶液反应的反应热分别为 △H1、△H2、△H3,则△H1、△H2、△H3三者的大小关系为___。
参考答案:(1)47.3
(2)CH3COOH的电离为吸热反应
本题解析:
本题难度:一般
3、填空题 用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃ (t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=_________(填表达式,不用化简) 若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”)若将稀硫酸换成浓硫酸来做该实验,测得的△H________(填“偏大”、“偏小”或“相同”)
参考答案:![]() 本题解析:
本题解析:
本题难度:一般
4、实验题 试回答下列中和热测定的有关问题:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑 料、泡沫塑料板、环形玻璃搅拌棒、0. 50 mol/L的盐 酸、0.55 mol/L的NaOH溶液,尚缺少的实验用品是_______________。
(2)实验时所用盐酸及NaOH溶液的体积均为 50 mL,各溶液的密度为1 g/cm3,生成溶液的比热容 c=4. 18 J/(g.℃),实验起始温度为T1℃,终止温 度为T2℃。试推断中和热的计算式:____________。
参考答案:(1)温度计、量筒(两个)
(2)![]()
本题解析:
本题难度:一般
5、选择题 将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
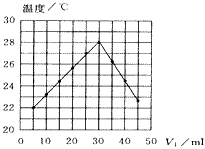 [???? ]
[???? ]
A.做该实验时环境温度为22℃
B.该实验表明化学能可转化为热能
C.NaOH溶液的物质的量浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
参考答案:B
本题解析:
本题难度:一般