微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? (填“是”或“否”),理由是 。
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有 。(多选)
A.NaOH
B.氨水
C.Cu2(OH)2CO3
D.Na2CO3
E.CuO
F.Cu(OH)2
参考答案:(4分)(1)① A &#
本题解析:
试题分析:(1)①NaClO在酸性条件下与Fe2+的反应是:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,由于反应过程中要消耗H+,溶液pH一定升高,选A;②NaClO可以将Fe2+氧化成Fe3+,但引入了新杂质Na+,实际上不能采用,必须应用既能氧化Fe2+又不能引入新杂质的氧化剂,例如Cl2、O2、H2O2等,答案为否 , 会引入新杂志Na+,造成产品不纯;(2)同理,调整pH所选用的试剂可以是CuO、Cu2(OH)2CO3、Cu(OH)2等不会引入新杂质的物质,选CEF。
考点:考查盐的水解,离子除杂等知识。
本题难度:一般
2、来源:91考试 网填空题 FeS饱和溶液中存在溶解平衡:FeS(s) Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为????????????????。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为???????????????。
参考答案:⑴7.92×10-8 g;⑵1.11×10-3mol/L。
本题解析:⑴由FeS(s) Fe2+(aq)+S2-(aq),[Fe2+]=
Fe2+(aq)+S2-(aq),[Fe2+]=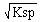 =
= 本题难度:一般
本题难度:一般
3、填空题 在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀,在白色沉淀中加入盐酸,沉淀溶解。
(1)试用离子方程式和有关平衡的知识解释_____________________
(2)根据上述判断,可得出酸盐跟反应的一种规律是_____________________
参考答案:(1)Ba2++C2O42-==BaC2O4↓、BaC2O4
本题解析:
本题难度:一般
4、简答题 常温下:Ksp〔Mg(OH)2〕=1.2×10-11mol3?L-3 Ksp(AgCl)=1.8×10-10mol2?L-2Ksp(Ag2CrO4)=1.9×10-12mol3?L-3,
Ksp(CH3COOAg)=2.3×10-3mol2?L-2下列叙述正确的是( )
A.等体积混合浓度均为0.2?mol?L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001?mol?L-1的AgNO3溶液滴入0.001?mol?L-1的KCl和0.001?mol?L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.121?mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以下
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
参考答案:A.等体积混合浓度均为0.1mol?L-1,c(CH3COO
本题解析:
本题难度:一般
5、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断
参考答案:A
本题解析:
试题分析:在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,NH4Cl溶于水水解:NH4Cl+ H2O NH3·H2O+HCl,导致溶液呈酸性,Mg(OH)2能够溶于酸,Mg(OH)2+2HCl==MgCl2+2H2O,故A项正确。
NH3·H2O+HCl,导致溶液呈酸性,Mg(OH)2能够溶于酸,Mg(OH)2+2HCl==MgCl2+2H2O,故A项正确。
考点:水解平衡应用。
本题难度:一般