微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的化学方程式书写正确的是
[???? ]
A.Na在空气中燃烧:4Na+O2 2Na2O
2Na2O
B.Fe粉与水蒸气反应:2Fe+6H2O(g) 2Fe(OH)3 +3H2
2Fe(OH)3 +3H2
C.常温下N2与O2混合:N2+O2 =2NO
D.SO3与NaOH溶液反应:SO3+2NaOH= Na2SO4+ H2O
参考答案:D
本题解析:
本题难度:简单
2、填空题 某稀硫酸和硝酸的混合溶液200 mL,分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。

(1)第二份溶液中最终溶质为 ;
(2)OA段产生的气体是 (填化学式),BC段产生的气体是 (填化学式),AB段的反应为 ;
(3)原混合酸中HNO3的物质的量为 mol,H2SO4的物质的量浓度应为 mol/L。
参考答案:(1)硫酸亚铁 (2)NO H2
本题解析:
试题分析:硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以原混合酸中n(NO3-)=2n(Fe)=  =0.4mol . 反应消耗22.4g铁,也就是
=0.4mol . 反应消耗22.4g铁,也就是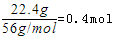 所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是4mol/l
所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是4mol/l
考点:本题以图象为载体,考查有关金属和酸反应的计算题
本题难度:困难
3、计算题 (6分)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
(1)配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
(2)每消耗草酸0.5mol,转移电子的物质的量为 mol;
(3)此人血液中的Ca2+的浓度为 mol·L-1。
参考答案:(各2分)(1)0.158 (2)1&
本题解析:
试题分析:(1)n(KMnO4)= 5.0×10-3 mol·L-1×0.2L=10-3 mol,KMnO4的质量为10-3 mol×158g/mol=0.158g。(2)反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O转移的电子为10e-,所以每消耗草酸0.5mol,转移电子的物质的量为1mol 。(3)根据反应方程式和元素守恒可得到关系式:2KMnO4~5H2C2O~5CaC2O4,消耗了2.0ml 5.0×10-3 mol·L-1KMnO4溶液,则CaC2O4的物质的量为:25×10-6mol,血样取了10ml,所以Ca2+的浓度为:25×10-3 mol÷(10×10-3)=2.5×10-3mol·L-1
考点:物质的量的计算、氧化还原反应的电子转移、元素守恒规律的应用。
本题难度:一般
4、选择题 右图是a、b两种固体物质的溶解度曲线。下列说法不正确的是(?????)

A.a的溶解度大于b的溶解度
B.在t℃时,a、b的饱和溶液中溶质的质量分数相同
C.将t℃时b的饱和溶液升温至40℃,其溶液中溶质的质量分数不变
D.10℃时,分别用100g水配制a、b的饱和溶液所需a的质量小于b的质量
参考答案:A
本题解析:
试题分析:温度低于25℃时,a的溶解度小于b的溶解度,温度高于25℃时,a的溶解度大于b的溶解度,因此错误的选项是A
点评:本题考查了温度对溶解度的影响,以及溶解度和质量分数之间的关系。本考点知识主要是初中化学知识。
本题难度:一般
5、选择题 新型陶瓷材料氮化硅(Si3 N4)可以通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO,下列就该反应的分析错误的是
Si3N4+6CO,下列就该反应的分析错误的是
A.压强增大,平衡向逆反应方向移动
B.SiO2是氧化剂,CO是氧化产物
C.上述反应若为放热反应,升高温度,平衡常数将减小
D.上述反应中每生成1 molSi3N4,氮元素得12mol电子
参考答案:B
本题解析:
试题分析:A. 该反应的正反应是个气体体积增大的反应,增大压强,根据化学平衡移动原理:化学平衡向逆反应方向移动。正确。B. 在该反应中,C的化合价从反应前单质C的0价变为反应后CO中的+2价,化合价升高,失去电子,作还原剂,N的化合价从反应前单质N2的0价变为反应后Si3 N4中的-3价,化合价降低,得到电子,被还原,作氧化剂。因此N2是氧化剂,CO是氧化产物。错误。C.上述反应若为放热反应,升高温度,化学平衡向逆反应方向移动,平衡常数将减小。正确。D.在上述反应中生成1 molSi3N4,电子转
本题难度:一般