微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
参考答案:(1)>
本题解析:强酸稀释100倍,PH=4,弱酸稀释PH<4;生成强碱弱酸盐,水解显碱性。(3)显酸性,醋酸过量,为CH3COOH和CH3COONa,(4)酸的电离度越小酸性越弱,pH相等的CH3COOH和HNO2,醋酸的浓度更大,消耗的碱醋酸要多些。
(5)CH3COOH CH3COO-+H+,因醋酸钠电离,使CH3COO-浓度增大,醋酸的电离平衡逆向移动,H+浓度下降,pH增大。
CH3COO-+H+,因醋酸钠电离,使CH3COO-浓度增大,醋酸的电离平衡逆向移动,H+浓度下降,pH增大。
本题难度:困难
2、选择题 下列事实中,能说明HNO2是弱电解质的是
A.用HNO2溶液做导电性试验,灯光较暗
B.HNO2是共价化合物
C.HNO2溶液不与氯化钠反应
D.常温下,0.1mol·L-1HNO2溶液的pH为2.15
参考答案:D
本题解析:
试题分析:A.没有用强酸在相同条件下进行对照,错误;B.电解质的强弱与共价化合物无直接关系,错误;C.在一般情况下强酸也不与NaCl反应,不能说明HNO2是弱酸,错误;D.若HNO2是强酸,其pH为1,由此说明HNO2是弱酸,属于弱电解质,选D。
考点:考查电解质强弱的判断。
本题难度:一般
3、选择题 已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质
| NaF
| NaClO
| Na2CO3
|
pH
| 7.5
| 9.7
| 11.6
?
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O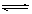 HClO + OHˉ的平衡常数K≈10ˉ7.6 HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
参考答案:C
本题解析:
试题分析:A、根据生成NaF所对应的酸为HF,生成NaClO所对应的酸为HClO,生成Na2CO3所对应的酸为HCO3-,生成NaHCO3所对应的酸为H2CO3,酸性:HCO3-<HClO <H2CO3<HF,所以,三种酸溶液的导电能力顺序:HClO<H2CO3<HF,错误;B、0.1 mol·L-1Na2CO3溶液中,c(Na+) =" 0.2" mol·L-1,将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,此时CO2过量,反应生成了NaHCO3,此时,溶液的体称没有变,溶液中
本题难度:一般
4、选择题 下列物质:①干燥的食盐晶体、②液态氯化氢、③硝酸钾溶液、④稀硫酸、⑤蔗糖溶液、⑥酒精,分别装入容器做导电性实验,灯泡会发光的物质有
A.①②③④⑤
B.全部不发光
C.全部都发光
D.③④
参考答案:D
本题解析:灯泡会发光要求存在自由移动的带电粒子;①干燥的食盐晶体虽然有带电离子,但不能自由移动,错;②液态氯化氢是由分子构成的共价化合物,不存在自由移动的带电离子,错;③硝酸钾溶液中存在自由移动的钾离子和硝酸根离子,正确;④稀硫酸中存在自由移动的氢离子和硫酸根离子,正确;⑤蔗糖属于分子构成的物质,其溶液中只存在在分子,不存在自由移动的带电离子,错;⑥酒精属于非电解质,错;所以正确答案为D。
本题难度:一般
5、选择题 下列事实不能说明一元酸HA为弱酸的是( )
A.常温下0.1 mol·L-1的HA溶液pH为5
B.常温下NaA溶液的pH>7
C.HA溶液中存在H+、OH-、A-、HA
D.HA溶液能与大理石反应
参考答案:D
本题解析:A项,c(H+)=1×10-5 mol·L-1<0.1 mol·L-1,说明HA未完全电离,即HA为弱酸;B项,NaA溶液pH>7,说明A-发生水解,即HA为弱酸;C项,HA溶液中有HA分子,说明HA为弱酸;D项,只能说明HA比H2CO3酸性强,不能说明HA为弱酸。
本题难度:一般
|