微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯化钴溶液中存在下列平衡:CoCl42-(蓝色) Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
A.由蓝色变为粉红色
B.红色加深
C.由粉红色变为蓝色
D.蓝色加深
参考答案:C
本题解析:
试题分析:向氯化钴稀溶液中加入一定量的浓盐酸,溶液中氯离子浓度增加,平衡向逆反应方向移动,所以溶液的颜色由粉红色变为蓝色,答案选C。
本题难度:一般
2、填空题 (10分) 25℃时,电离平衡常数:
化学式
| CH3COOH
| H2CO3
| HClO
| H2C4H4O6(酒石酸)
| H2SO3
|
电离平衡常数
| 2.0×10-5
| K1=4.3×10-7
K2=5.6×10-11
| 3.0×10-8
| K1=9.1×10-4
K2=4.3×10-5
| K1=1.3×10-2
K2=6.3×10-8
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH== (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-)>c(ClO-) > c(H+)
C.c(Na+) ==" c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
参考答案:(1) e c d b a (2)2.85(2分
本题解析:
试题分析:(1)分析题给电离平衡常数知,酸性:HC4H4O6—>CH3COOH> H2CO3>HClO> HCO3—,根据盐类水解规律:形成盐的酸根对应酸越弱,该盐的水解程度越大,同浓度溶液的碱性越强,PH越大,可知,物质的量浓度相同这五种盐溶液的PH:Na2CO3>NaClO >NaHCO3>CH3COONa> Na2C4H4O6,则pH相同的五种盐溶液的物质的量浓度:Na2CO3<NaClO <NaHCO3<CH3COONa< Na2C4H4O6,由大到小的顺序是e c d b a;(2)设0.1mol/L的CH3COOH溶液中氢离子浓度为x,代入醋酸的电离常数表达式得:x2/0.1=2.0×10-5,解得x=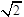 ×10-3,PH=2.85;(3)根据题给信息知,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,发生的反应为: ×10-3,PH=2.85;(3)根据题给信息知,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,发生的反应为:
HClO+ Na2CO3= NaClO+ NaHCO3,所得溶液为浓度均为0.05mol/L的NaClO和 NaHCO3的混合液,A、ClO-的水解程度大于HCO3-,则c(HCO3-) >c(ClO-) ,错误;B、c(Na+) > c(HCO3-) >c(ClO-) > c(H+),正确;C、根据物料守恒知,c(Na+)="c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-),正确;D、根据电荷守恒知,c(Na+) + c(H+)= c(ClO-)+ c(HCO3-) + 2c(CO32-)+ c(OH-),错误;E、根据物料守恒和电荷守恒知,c(HClO) + c(H+)+ c(H2CO3)= c(OH-) + c(CO32-),正确;选BCE;(4)根据题意知H2CO3>HClO> HCO3—,少量的CO2通入NaClO溶液中的化学方程式为CO2+ NaClO+ H2O= NaHCO3+ HClO;(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液为0.05mol/L的NaHC4H4O6,根据电荷守恒式可知,c(HC4H4O6-)+2 c(C4H4O62-)= c(Na+) + c(H+) —c(OH-)= (0.05+10-6-10-8)mol/L ="0.05000099" mol/L。
考点:考查电解质溶液,涉及弱电解质的电离和盐类的水解。
本题难度:困难
3、选择题 pH=2的A.B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是
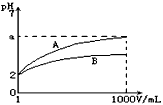 [???? ] [???? ]
A.A.B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A.B都是弱酸,则5≥a>2
参考答案:C
本题解析:
本题难度:一般
4、选择题 用水稀释0.1mol L
参考答案:
本题解析:
本题难度:一般
5、选择题 下列溶液的导电能力变化最大(忽略溶液体积变化)的是(???? )
A.向100mL含有0.05 molHCI的溶液中加入等物质的量的NaOH固体
B.向100mL含有0.05 molCH3COOH的溶液中通入等物质的量的氨气
C.向100mL含有0.05 molHCI的溶液中加入等物质的量的NaHCO3固体
D.向100mL含有0.05 molCa(OH)2的澄清石灰水中通入标况下224mLCO2气体
参考答案:B
本题解析:溶液的导电性强弱只与溶液中阴阳离子的浓度大小和离子所带电荷数有关系。选项A中反应后生成氯化钠,离子的浓度变化不大,导电性变化不大;选项B中醋酸是弱酸,反应后生成强电解质醋酸铵,导电性增强;选项C中反应后生成氯化钠,离子的浓度变化不大,导电性变化不大;选项D中恰好生成碳酸氢钙,所以离子的浓度变化不大,导电性变化不大,答案选B。
本题难度:一般
|