微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据:

①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
A.增大容器的容积
B.再充入一定量的N2O4
C.再充入一定量的NO2
D.再充入一定量的He
(3)常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液,消耗盐酸的体积分别为V1、V2,则V1_____V2(填“>”“<”或“=”下同);
②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,消耗盐酸的体积分别为V3、V4,则V3_____V4;
③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,最后溶液均为中性,消耗盐酸的体积分别为V5、V6,则V5_____V6。
参考答案:(1)CH4(g) +2O2 (g)→CO2(g)+2H2O
本题解析:
试题分析:(1)356g“可燃冰”的物质的量是356g÷178g/mol=2mol。则其中含有的甲烷的物质的量是2mol,能放出1780.6 kJ的热量,则1mol的甲烷完全燃烧产生稳定的化合物时所放出的热量是1780.6 kJ÷2mol=890.3 kJ.甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-890.3 kJ/mol; (2) ①从表中分析:该反应达到平衡时N2O4的平衡浓度是0.04mol/L、NO2平衡浓度是0.12mol/L,则反应的平衡常数为K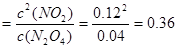 ;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)=
;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)= ; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
考点:考查热化学方程式的书写、化学平衡常数、化学反应速率的计算、酸碱中和反应时体积关系的计算。
本题难度:困难
2、填空题 (4分)中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显________色,溶液呈________性(填“酸”、“碱”或“中”)。
(2)若用pH计测定,则pH________7.0(填“>”、“<”或“=”),溶液呈________性(填“酸”、“碱”或“中”)。)】
参考答案:(1)淡黄; 中 (各1分)
(2)< ;中?(各1分
本题解析:
试题分析:
(1)100℃时,水呈中性,PH不变色。
(2)100℃时,水呈中性时的pH=6。
点评:本题属于简单题,关键抓住不论在什么温度下,水都是中性,会发生改变的是水的离子积。
本题难度:一般
3、选择题 下列说法正确的是(????)
A.某溶液中所有离子的浓度大小排序是:c(CH3COO—)>c(Na+)>c(H+)>c(OH—),则该溶液的溶质一定是CH3COONa和C H3COOH
H3COOH
B .CH3COOH与NaOH的混合溶液显碱性,则溶液中各离子浓度大小排序一定为
.CH3COOH与NaOH的混合溶液显碱性,则溶液中各离子浓度大小排序一定为
c(Na+)>c(CH3COO—)>c(OH—)>c (H+)
C.常温下,a mol/L 的CH3COOH溶液与b mol/L NaOH溶液等体积混合后溶液的pH=7,则一定有a=b
D.常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH一定等于7
参考答案:A
本题解析:略
本题难度:一般
4、选择题 如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
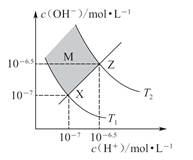
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
参考答案:D
本题解析:
试题分析:D项中,XZ线上任意点均为中性,是c(H+)=c(OH-),但pH=-lg c(H+),不一定是7。+)和c(OH-)的关系。
本题难度:一般
5、选择题 在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液中,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A.HNO2
B.HCOOH
C.HCN
D.H2CO3
参考答案:C
本题解析:略
本题难度:一般