微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某温度下,NaOH的溶解度为20克,该温度下将80克NaOH放入220克水中,充分搅拌后,测的溶液的密度为1.2 g/mL ,则溶液中溶质的物质的量浓度为[???? ]
A. 0.02mol/L
B.? 2.0mol/L
C. 5.0 mol/L
D. 7.5mol/L
参考答案:C
本题解析:
本题难度:简单
2、选择题 等质量的SO2和SO3( )
A.所含氧原子的个数比为2:3
B.所含硫原子的个数比为1:1
C.所含氧元素的质量比为5:6
D.所含硫元素的质量比为5:6
参考答案:根据n=mM
本题解析:
本题难度:简单
3、选择题 设氯原子的质量为a g,12C原子的质量为b g,用Na表示阿伏加德罗常数的值,则下列说法正确的是(??? )
①氯元素的相对原子质量为 ?②m g该氯原子的物质的量为
?②m g该氯原子的物质的量为 mol?③该氯原子的摩尔质量是aNa g?④n g该氯原子所含的电子数是
mol?③该氯原子的摩尔质量是aNa g?④n g该氯原子所含的电子数是
A.①②
B.③④
C.①③
D.②④
参考答案:D
本题解析:①中, 为该氯原子相对原子质量,而不是氯元素的相对原子质量。②中,m g氯原子中含
为该氯原子相对原子质量,而不是氯元素的相对原子质量。②中,m g氯原子中含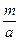 个氯原子,物质的量应为
个氯原子,物质的量应为![]()
本题难度:简单
4、填空题 (8分)H2SO4的摩尔质量是 ,196g H2SO4的物质的量是 ,其中含有 g O和 molH。
参考答案:98g/L 2mol 1
本题解析:
试题分析:如果质量的单位用g表示,则摩尔质量在数值上等于物质的相对分子质量或相对原子质量,所以硫酸的摩尔质量是98g/mol。根据n=m/M可知,196g硫酸的物质的量是196g÷98g/mol=2mol。根据硫酸的化学式可知,含有2mol×2=4mol氢原子和2mol×4mol=8mol氧原子,则氧原子的质量是16g/mol×8mol=128g。
考点:考查物质的量的有关计算
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式 、n=m/M、
、n=m/M、 、
、 等。
等。
本题难度:一般
5、选择题 铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。
根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4 [ 已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4?]。需要加入FeCl3(s) ??????????????g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
?????????????????mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(4)有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+ · Fe3+[ Fe3+(1-x) · Cr3+x · O4]。向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况)。计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量。
②所得气体中NO、NO2的体积比。
参考答案:(1)32.5 g(3分)
(2)350mL(2分,1
本题解析:
试题分析:(1)按题中所给,1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4其中,Fe(OH)2来自铁粉,Fe(OH)3来自FeCl3。为达到1:2的关系,需要氯化铁0.2mol,质量 32.5g。
(2) 9.0g的MgO 2Fe2O3 共0.025mol,其中有0.025molMg2+、0.1molFe3+,需要NaOH 0.35mol ,即题中溶液350ml;
(3)①氯气的物质的量为 本题难度:一般
本题难度:一般