微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度时,在2L容器中X、Y、Z三种物质随时间的
变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的 生成速率 (大、小、相等)。
参考答案:(1)3X+Y 本题解析:
本题解析:
试题分析:(1)由“化学方程式的计量系数与反应速率(或变化量)成正比”,通过计算反应过程中的变化量之比即得到反应方程式的化学计量系数,从而得出此反应的方程式为3X+Y 2Z。
2Z。
(2)根据平均反应速率的计算公式即可解答。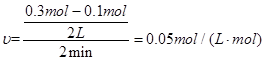
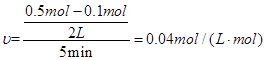
(3)5min时,反 应达到了平衡,各物质的反应速率不再改变,故5min后Z的生成速率与5min末Z的生成速率相等。
考点:化学反应速率
点评:利用反应速率的公式判断、计算反应速率的大小是高考必考知识点,考生应掌握并灵活应用。
本题难度:一般
2、计算题 (6分)在一个容积为3L的密闭容器内进行如下反应:
N2(气)+3H2(气) 2NH3(气)。反应开始时,n(N2)=1.5mol,n(H2)= 4.4mol,2min后,n(H2)=0.8mol。试用H2、N2和NH3的浓度变化来表示该反应的反应速率,并求出2min末的N2的浓度。
2NH3(气)。反应开始时,n(N2)=1.5mol,n(H2)= 4.4mol,2min后,n(H2)=0.8mol。试用H2、N2和NH3的浓度变化来表示该反应的反应速率,并求出2min末的N2的浓度。
参考答案:0.6mol/LS,0.2 mol/LS,0.4 mol/L
本题解析:略
本题难度:简单
3、选择题 控制变量法是科学研究中的一种常用方法,下表中产生H2速率最快的是???
编号
| 金属(粉末状)
| 物质的量
| 酸的浓度
| 酸的体积
| 反应温度
|
A
| Al
| 0.2 mol
| 18.4mol/L H2SO4
| 10mL
| 30℃
|
B
| Mg
| 0.2 mol
| 3 mol/L H2SO4
| 20mL
| 30℃
|
C
| Fe
| 0.1 mol
| 3 mol/L H2SO4
| 20mL
| 60℃
|
D
| Mg
| 0.1 mol
| 3 mol/L H2SO4
| 10mL
| 60℃
参考答案:D
本题解析:
试题分析:18.4mol/L H2SO4浓度较大,使得Al发生钝化,镁的金属活泼性比铁大,故镁与硫酸反应产生氢气的速率较快。反应速率还与温度有关,温度越高,反应速率越大,溶液的体积对反应速率无影响。
点评:化学平衡与化学速率是历年高考必考知识点,考生在备考过程中要注意分别两者的影响因素。
本题难度:一般
4、填空题 O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。
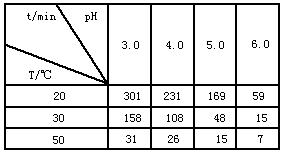
已知:O3的起始浓度为0.021 6 mol/L。
(1)pH增大能加速O3分解,表明对O3 分解起催化作用的是____。
(2)在30℃、pH=4.0条件下,O3的分解速率为____ mol/(L·min)。
(3)据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为 ____。(填字母代号)
a. 40℃、pH=3.0
b.10℃、pH=4.0
c.30℃、pH=7.0
参考答案:(1)OH-
(2) 1.00×10-4
(
本题解析:
本题难度:一般
5、选择题 同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件中最佳组合是?? ?
①纯锌粒;②粗锌片;③0.01 mol·L-1盐酸;④0.01 mol·L-1硫酸;⑤98%硫酸;⑥加热; ⑦用冰水冷却
A.①③⑦
B.②④⑥
C.②③⑥
D.①⑤⑥
参考答案:B
本题解析:
试题分析:影响速率的因素是浓度、温度、压强、催化剂,固体的表面积和是否能形成原电池。所以应该选用粗锌在较浓的酸中反应,并加热。最佳组合是②④⑥,答案选B。
点评:浓硫酸虽然浓度很大,但是不能跟锌反应放出氢气,所以不符合本题题意。
本题难度:一般
|