微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol ? L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na202固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 NA
参考答案:D
本题解析:
试题分析:A项lmol FeI2与足量氯气反应时转移的电子数应该为3NA(Fe2+、I-均被氧化),错误;B项2 L0.5 mol ? L-1硫酸钾溶液中SO42-所带电荷数应该为2NA,错误;C项1 mol Na202固体中含离子总数应该为3NA,错误。D项丙烯和环丙烷为同分异构体,故42 g混合气体中氢原子的个数为6 NA,正确。
本题难度:一般
2、填空题 某金属氯化物M?Cl227.0g含有0.4molCl-,则M?Cl2的物质的量为______金属M的相对原子质量为______.
参考答案:27.0gMCl2含有0.4molCl-,由化学式MCl2可
本题解析:
本题难度:一般
3、选择题 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为
A. mol·L-1
mol·L-1
B. mol·L-1
mol·L-1
C.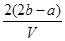 mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
参考答案:C
本题解析:
试题分析:设每份中镁离子的物质的量为x,硫酸根离子的物质的量为y,则由
Mg2++2OH-=Mg(OH)2↓可知,
1 2
x amol
解得x=0.5amol
由Ba2++SO42-=BaSO4↓可知
1 1
bmol y
解得y=bmol
忽略溶液中的H+和OH-由电荷守恒知
溶液中K+的物质的量为(b-0.5a)×2mol=(2b-a)mol
又由于混合溶液分成两等份,则原溶液中的K+的物质的量为2(2b-a)mol
则原混合溶液中钾离子的浓度为 mol·L-1,所以答案选D。
mol·L-1,所以答案选D。
考点:考查溶液中根据方程式进行的离子浓度的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生能力的培养。该题的关键是明确信息中恰好使离子转化为沉淀,然后利用离子之间的反应、电荷守恒、物质的量浓度的计算即可解答。
本题难度:一般
4、填空题 (4分)已知NA为阿伏加德罗常数,如果a g某气体中含有该气体的分子数为b,则该气体的物质的量为 ,若c g该气体在标准状况下的体积为 &# 160; 。(上述两空请用字母NA a b c表示)
参考答案:每空2分,共4分
本题解析:略
本题难度:一般
5、选择题 下列叙述正确的是(????? )
A.气体摩尔体积就是22.4L/mol
B.在标准状况下,1mol任何气体所占的体积都是22.4L/mol
C.在标准状况下,1mol任何气体所占的体积都约是22.4L
D.在标准状况下,1mol水所占的体积约为22.4L
参考答案:C
本题解析:
试题分析:标准状况下,1mol任何气体所占的体积都约是22.4L,A、B错误,C正确;标准状况下水不是气体,D错误。
点评:标准状况下,1mol任何气体所占的体积都约是22.4L,注意其中的关键词:标准状况、1mol、任何气体、约是22.4L。
本题难度:一般