微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能
A.②⑤
B.③⑤
C.①②
D.④⑤
参考答案:A
本题解析:
试题分析:①锌片、铜片和稀硫酸溶液构成的原电池中,铜作正极,正极上氢离子得电子生成氢气,所以硫酸浓度减小,故①错误;②铜作正极,正极上氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑,故②正确;③该原电池中锌失电子变成锌离子进入溶液,所以锌作负极,铜作正极,故③错误;④锌失电子通过导线流向铜,所以电子流向为由Zn经导线流入Cu片,即从负极通过导线流向正极,故④错误;⑤原电池是将化学能转变为电能的装置,故⑤正确,故选A。
本题难度:一般
2、选择题 以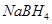 (B元素的化合价为+3)和
(B元素的化合价为+3)和 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是

A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:
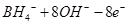 =
=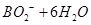
D.电路中通过6.02×1022个电子时,理论上消耗 mol
mol
参考答案:D
本题解析:
试题分析:B、H2O2具有强氧化性,易得电子,所以电极b为原电池的正极,正确;A、电池内部阳离子向正极移动,所以该电池工作时Na+由a极区移向b极区,正确;C、BH4-在负极上失去电子,生成BO2-,配平可得电极方程式:BH4-+8OH?—8e?= BO2-+6H2O,正确;D、根据化合价的变化可得H2O2与转移电子的对应关系:H2O2 ~2e?,所以电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol。
本题难度:简单
3、选择题 下列事实不能用电化学原理解释的是
A.常温条件下,在空气中铝不容易被腐蚀
B.镀锌铁片比镀锡铁片更耐腐蚀
C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜
D.远洋海轮的尾部装上一定数量的锌板
参考答案:A
本题解析:
试题分析:铝是活泼的金属,在其表明极易被氧化生成一层致密的氧化膜,所以铝制容器是耐腐蚀的,和电化学原理无关系。其余选项BCD都是和原电池原理有关系即都是和电化学原理有关的,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对电化学原理应用的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力。试题贴近高考,基础性强,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
4、选择题 下列叙述正确的是( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-═CO2↑+5H2O
C.在铁上镀铜时,金属铜作阴极
D.电解MgCl2溶液可制得Mg单质
参考答案:A、纯锌与稀硫酸反应时,加入少量CuSO4溶液,在锌表面析出
本题解析:
本题难度:一般
5、简答题 在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:______负极:______.但在实际实验中,锌片上也有______、表面变黑等现象,其原因是______.
在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率______(选填“要快”、“要慢”、“相等”、“无法确定”),其微观解释是______.
参考答案:该原电池中,铜片上,氢离子得电子生成氢气,所以看到的现象是:
本题解析:
本题难度:一般