2.4
A.若A的浓度增加到原平衡的2倍,则平衡一定正向移动
B.该反应的ΔH>0
C.在850℃条件下,反应达到平衡时,容器中各物质的浓度一定相等
D.A的转化率越大,平衡常数越大
参考答案:B
本题解析:所给反应为两边气体系数相等的可逆反应,升温时K增大,即平衡右移,正反应为吸热反应,也就是说ΔH>0,B正确
A:比如将容器体积减小为原来的一半,各物质的浓度均为原来的两倍,相当于加压,平衡并不移动;
C:在850℃条件下,反应达到平衡时,K=1=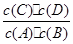 ,而不是各物质的浓度相等。 ,而不是各物质的浓度相等。
D:平
本题难度:一般
2、填空题 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl 2 =4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为_____________,发生的电极反应为______________________;
(2)电池正极发生的电极反应为________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到
SOCl2中,实验现象是______________________,反应的化学方程式为________________________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是__________________________。
参考答案:(1)锂;Li-e-=Li+
(2)2SOCl2+4
本题解析:
本题难度:一般
3、填空题 科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。
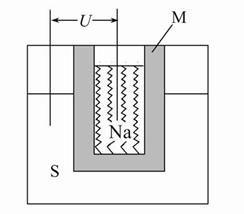
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
参考答案:(1)2CH3CH2OH+2Na 本题解析:(2)正极的电极反应式为:xS+2e-= Sx2-,M的作用:一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的(207/23)∶2=4.5倍。 本题解析:(2)正极的电极反应式为:xS+2e-= Sx2-,M的作用:一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的(207/23)∶2=4.5倍。
(3)根据电离与水解的知识可判断:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),加入少量固体CuSO4后,溶液中发生离子反应:Cu2++S2-=CuS↓,由于c(S2-)降低,故由S2-水解产生的OH-量减小,c(OH-)变小,c(H+)变大,溶液的pH减小;Na2S溶液长期放置所发生的化学反应方程式为2Na2S+O2+2H2O=4NaOH+2S↓,故离子方程式为2S2-+O2+2H2O=4OH-+2S↓。
本题难度:困难
4、选择题 下列叙述中不正确的是
①电子从原电池正极经导线流向负极
②电子从原电池负极经导线流向正极
③原电池中电子从发生氧化反应的电极流出
④原电池中电子从发生还原反应的电极流出
⑤原电池中的两个电极,相对活泼的金属是负极
A.①③
B.②④
C.①④
D.②③⑤
参考答案:C
本题解析:
本题难度:简单
5、简答题 关于锌铜-稀硫酸原电池的叙述,错误的是( )
A.氢离子在铜表面被还原,产生气泡
B.电流从锌片经导线流向铜片
C.电子从锌片经导线流向铜片
D.锌是负极,其质量逐渐减小
参考答案:A.锌作负极、铜作正极,正极上氢离子得电子生成氢气,所以氢离
本题解析:
本题难度:一般
|