微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将AgNO3、Na2SO4、BaCl2三种物质按分子数为2∶1∶1的比例混合后溶于足量水中,最终溶液中大量存在的离子是
A.Ba2+和NO3-
B.Na+和Cl-
C.Na+和NO3-
D.Ag+和SO42-
参考答案:C
本题解析:将三种物质按分子数为2∶1∶1的比例混合后溶于足量水中,Ag+和Cl-、SO42-和Ba2+恰好完全反应转化成AgCl和BaSO4沉淀,最终溶液中大量存在的离子是Na+和NO3-。
本题难度:一般
2、填空题 (9分)现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离子
| H+、Na+、A13+、Ag+、Ba2+
|
阴离子
| OH-、Cl-、NO3-、CO32-、SO42-
?
已知:
① A、B两溶液呈碱性,C、D、E溶液呈酸性。
常温下,0.1mol/L A溶液的pH小于13,
0.1mol/L C溶液的pH小于1。
②A溶液与E溶液反应既有气体又有 沉淀产生; 沉淀产生;
A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)写出D的化学式:???????????????。
(2)将E溶液加热蒸干并灼烧所得产物的名称为:??????????????;
(3)写出A、E溶液反应的离子方程式:????????????????????;
(4)写出B溶液与C溶液恰好完全反应至溶液呈中性的离子方程式: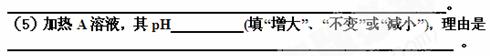
参考答案: 本题解析:略 本题解析:略
本题难度:一般
3、选择题 下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:
B.用小苏打治疗胃酸过多:
C.向NaHSO4溶液中滴加Ba(OH)2溶液至恰好为中性:2OH-+Ba2++SO42-+2H+═BaSO4↓+2H2O
D.碳酸氢铵溶液与过量的氢氧化钠溶液共热:
参考答案:C
本题解析:分析:A.反应生成氢氧化铝、氯化铵;
B.小苏打为碳酸氢钠,与盐酸反应生成氯化钠、水、二氧化碳;
C.恰好为中性,反应生成硫酸钡、硫酸钠、水;
D.反应生成碳酸钠、水、氨气.
解答:A.氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.用小苏打治疗胃酸过多的离子反应为HCO3-+H+═CO2↑+H2O,故B错误;
C.向NaHSO4溶液中滴加Ba(OH)2溶液至恰好为中性的离子反应为2OH-+Ba2++SO42-+2H+═BaSO4↓+2H2O,故C正确;
D.碳酸氢铵溶液与过量的氢氧化钠溶液共热的离子反应为HCO3-+NH4++2OH- NH3↑+CO32-+2H2O,故D错误; NH3↑+CO32-+2H2O,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意氢氧化铝的两性,选项C为解答的难点,题目难度不大.
本题难度:困难
4、实验题 洗车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅含Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另外一种单质。化合物丙置于空气中可转化为可溶性盐和一种气态单质。
请回答下列问题:
(1)甲的化学式为???????????,丙的电子式为???????????。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为????????????????????;
将该碳酸氢盐溶于水配成溶液,则溶液中各离子浓度大小关系为:?????????????????。?
(3)单质乙与红棕色粉末发生反应的化学方程式为???????????????????????????,安全气囊中红棕色粉末的作用是???????????。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是???????????。
A.KCl
B.KNO3
C.Na2S
D.CuO
参考答案:(1)NaN3, 本题解析:略 本题解析:略
本题难度:简单
5、选择题 在含有Fe2+、Fe3+、Mg2+、NH4+的溶液中,加入足量的Na2O2固体,充分作用后,再加入过量稀盐酸,溶液中离子数目没有发生变化的是
[???? ]
A. Fe2+
B. Fe3+
C. Mg2+
D. NH4+
参考答案:C
本题解析:
本题难度:一般
|