微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将装有1 molHI的容器密封并加热,部分HI分解成H2和I2(g)并达到化学平衡,此时I2(g)的体积分数为x%.若在该容器中加入2 molHI后密封,加热到相同温度使之达到平衡时,设此时I2(g)的体积分数为y%,则x与y的关系为
A.x>y
B.x<y
C.x=y
D.x≥y
参考答案:C
本题解析:本题是在恒温、恒容的条件下进行,加入2 molHI的状态是相当于对装有1 molHI的容器进行加压,加压对本反应没有影响,所以x=y
本题难度:困难
2、选择题 用3 g铁屑与适量1 mol/L稀硫酸反应制取H2气体,若要增大反应速率,可采取的措施是:
①再加入适量1 mol/L硫酸
②改用3 mol/L硫酸
③改用3 g铁粉
④适当升高温度
⑤加几滴CuSO4溶液
⑥用浓硫酸代替1 mol/L稀硫酸
A.①②④⑤
B.②③④⑤
C.①③④⑤
D.②③④⑤⑥
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列物质的变化中,没有化学键明显被破坏的是
A.I2升华
B.NaCl固体溶于水
C.HCl溶于水得到盐酸
D.从NH4HCO3中闻到了刺激性气味
参考答案:A
本题解析:NaCl、HCl溶于水而发生电离,化学键破坏;NH4HCO3中有刺激性气味,说明分解产生了NH3,发生了化学变化,有化学键被破坏;碘升华是物理变化,不破坏化学键.
本题难度:简单
4、选择题 &nbs p;关于下列图示的说法中,正确的是
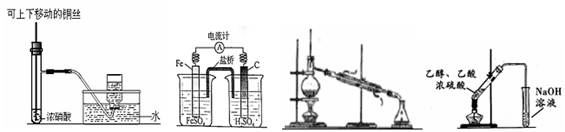
? ? ? ? ?图1??????????????图2?????????????图3????????????????图4
A.图1制备并收集少量NO2气体
B.图2是原电池装置,Fe电极为负极
C.图3常用于分离互不相溶的液体
D.图4可用于实验室制取和收集乙酸乙酯
参考答案:B
本题解析:试题分析:铜与浓硝酸反应可以制备NO2,但是NO2易溶于水,与水反应生成硝酸和NO,因此不能用排水法收集NO2,只能用向上排空气法收集,故A选项错误;铁与稀硫酸能发生置换反应,Fe比C容易失去电子,则图2是原电池,Fe是负极,C是正极,故B选项正确;图3代表蒸馏,用于分离互溶液体混合物,且各组成成分的沸点相差较大,分离互不相溶的液体的操作是分液,故C选项错误;乙醇、乙酸在浓硫酸催化加热下发生酯化反应,可以制备乙酸乙酯,但是不能用NaOH溶液除去乙酸乙酯中混入的少量乙醇和乙酸,因为乙酸乙酯也能与NaOH溶液反应,应选择饱和Na2CO3溶液除杂,故D选项错误。
考点:考查化学实验基本操作,主要涉及二氧化氮的实验室制法、原电池的 构成条件和电极类型、混合物分离提纯的常见方法、乙酸乙酯的制法和提纯等。
本题难度:简单
5、选择题 下列说法正确的是
A.NaCl熔化、冰融化时均有化学键被破坏
B.氢键是化学键的一种
C.HF、HCl、HBr中H-X键能越来越小,所以它们的熔、沸点越来越低
D.由于液氨中含有氢键,所以氨的沸点比PH3、AsH3要高
参考答案:D
本题解析:物质熔化时破坏的是直接构成物质的微粒之间的作用,构成离子化合物的阴、阳离子之间是离子键,而冰、HF、HCl、HBr等由分子直接构成物质,微粒间的作用是分子间作用力,分子内的化学键强弱不影响物质的熔、沸点.氢键是分子间作用力,不是化学键,它影响物质的熔、沸点.
本题难度:简单