微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究
取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是____________________。
(3)进一步探究
完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
实验步骤
| 预期现象和结论
|
?
| ?
|
?
| ?
参考答案:(14分)(1)红色粉末只含Cu2O (4分)???
本题解析:略
本题难度:一般
2、选择题
A.等于50 mL
B.大于50 mL
C.等于100 mL
D.大于100 mL
参考答案:D
本题解析:参加反应的硫酸的物质的量为1.8 mol,耗去硫酸的体积为100 mL,但是硫酸在反应过程中会变稀,为保证硫酸维持高浓度,总体积必须大于100 mL。
本题难度:简单
3、填空题 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方程式____________________________.
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO)=______mol/L.
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.
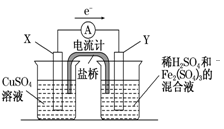
?
| 正、负极判断
| 电极材料
| 电极反应式
| X极
| ?
| ?
| ?
| Y极
| ?
| ?
| ?
参考答案:(1)Cu+2Fe3+===Cu2++2Fe2+
(2
本题解析:
考查知识点:离子反应;电化学基础;
解答过程:(1)混合液中存在H2SO4和Fe2(SO4)3,铜为不活泼金属,不与H2SO4反应;但Fe3+具有氧化性,可将铜单质氧化为铜离子:Cu+2Fe3+===Cu2++2Fe2+ 。
(2)pH=1,则c(H+)=0.1mol/L;则c(Cu2+)=c(H+)=0.1mol/L;则反应生成的铜离子的物质的量为n(Cu2+)=0.1mol/L×100×10—3L="0.01mol" 。
设反应消耗的铜、Fe3+的物质的量为a、b
C
本题难度:一般
4、选择题 FeSO4和Fe2(SO4)3的混合物中含硫的质量分数为a%,则含铁的质量分数为(?????? ).
A.2a%
B.3a%
C.1-2a%
D.1-3a%
参考答案:D
本题解析:在FeSO4和Fe2(SO4)3的混合物中,硫元素和氧元素质量比是固定的,即1:2,所以,氧的质量分数为2%,铁的质量分数为1-3a%,故选D
本题难度:一般
5、填空题 判断存放的FeCl2溶液是否变质。从现象观察看????????????????????????????;鉴定的方法为加入?????????试剂,若溶液出现 ???????????????????????????????;则证明有????????????存在。实验室为了防止FeCl2溶液变质,在配制时常加入 ???? ??? 和 ????? 。向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象????????????????????????????????????????。 ???????????????????????????????;则证明有????????????存在。实验室为了防止FeCl2溶液变质,在配制时常加入 ???? ??? 和 ????? 。向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象????????????????????????????????????????。
参考答案:溶液是否变为黄色;KSCN;血红色; Fe3+; 铁粉.盐酸
本题解析:略
本题难度:一般
|
|