微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 海水中有取之不尽的化学资源,从海水中可提取多种化工原料,下图是某工厂对海水资源的综合利用的示意图:

回答下列问题:
(1)操作A的实验名称为:???▲???,B的化学式为???▲???
(2)镁是活泼的金属,能在二氧化碳中燃烧,反应方程式为:???????▲????????????
参考答案:(1)过滤?(1分), NaOH?(2分)
(2)2M
本题解析:略
本题难度:简单
2、选择题 下列金属冶炼的反应原理,错误的是(??)。
A.2NaCl(熔融)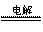 2Na+Cl2↑
2Na+Cl2↑
B.Al2O3+3H2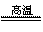 2Al+3H2O
2Al+3H2O
C.Fe3O4+4CO 3Fe+4CO2↑
3Fe+4CO2↑
D.2HgO 2Hg+O2↑
2Hg+O2↑
参考答案:B
本题解析:金属的冶炼一般是根据金属活泼性选择,金属性越强的,采用电解法,越不活泼的金属采用热分解法,处于中间的金属一般采用还原剂还原。铝是活泼的金属,应该通过电解法,工业上用电解熔融的氧化铝来冶炼金属铝,所以答案选B。
本题难度:简单
3、填空题 磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
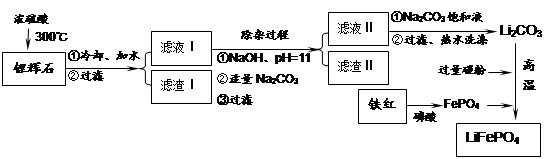
已知:2LiAl(SiO3)2 + H2SO4(浓) 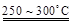 ?Li2SO4 + Al2O3·4SiO2·H2O↓
?Li2SO4 + Al2O3·4SiO2·H2O↓
温度/℃
| 20
| 40
| 60
| 80
|
溶解度(Li2CO3)/g
| 1.33
| 1.17
| 1.01
| 0.85
|
溶解度(Li2SO4)/g
| 34.2
| 32.8
| 31.9
| 30.7
?
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式?????????。
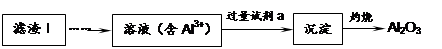
(2)滤渣Ⅱ的主要成分是:????????????(填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是?????????????
?????????????????????????????????????????????????????????????????。
(4)写出在高温下生成磷酸亚铁锂的化学方程式????????????????????????。
(5)磷酸亚铁锂电池总反应为:FePO4+Li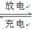 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:????????????????????????????。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为?????????????????。 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:????????????????????????????。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为?????????????????。
参考答案:(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4
本题解析:
试题分析:(1)由已知化学方程式可知,滤渣Ⅰ的主要成分是Al2O3·4SiO2·H2O,要通过灼烧沉淀生成氧化铝,故沉淀为氢氧化铝,则必须加入过量的弱碱,如氨水;(2)锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐),故用氢氧化钠先中和过量的浓硫酸,再调高pH值,使镁离子变成氢氧化镁沉淀析出,钙离子则通过加入碳酸钠,生成碳酸钙沉淀析出,故滤渣Ⅱ的主要成分是Mg(OH)2、CaCO3;(3)由表中数据可知,Li2CO3的溶解度随温度升高而减小,故通过热水洗涤可减少碳酸锂的损失;(4)因加
本题难度:困难
4、填空题 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
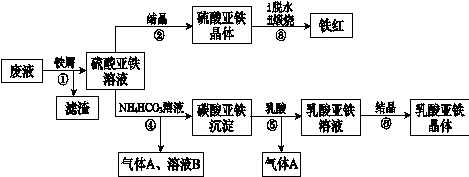
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是?????????????????????。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、??????????????????????????????????????????。
(1)步骤④的离子方程式是???????????????????????????????????????????????????????????。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及???????????????????????????。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为?????????????。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因????????????????????????????。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)??????????????????。
参考答案:
(1)玻璃棒、烧杯、漏斗??(1分) ;冷却结晶、过
本题解析:
试题分析:
(1)过滤用的仪器:玻璃棒、烧杯、漏斗??;“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
(2)Fe2++2HCO3-→FeCO3↓+H2O+CO2↑?????
(3)隔绝空气,防止Fe2+被氧化 。?
(4)4FeSO4+ O2 =4SO3? + 2 Fe2O3???氧化剂O2和还原剂FeSO4的物质的量之比?? 1: 4?。???
(6)FeSO4和KMnO4反应的关系式 解:设20.00 m
本题难度:困难
5、简答题 (1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为______.该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是______.
(2)除去FeCl2溶液中少量的FeCl3最好加入______物质.
(3)鉴别Na2CO3和NaHCO3溶液可选用______(填序号).
①NaOH ②Ca(OH)2 ③BaCl2④K2SO4 ⑤Ca(NO3)2
(4)某溶液中有①SO42-②Mg2+③Fe2+④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是______.
(5)将盛有18mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是______.
①1.2mL ②2.4mL ③3.6mL ④5.2mL
A.①②B.①③C.②④D.①④
参考答案:(1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳
本题解析:
本题难度:一般
|