12.2
请回答下列问题:
(1)预处理时,将煤矸石焙烧2小时的目的是??????????????????????。
(2)酸浸操作中,过量H2SO4的作用是??????????????????????????。
在实验室中进行该操作时,用到玻璃仪器有??????、?????。
(3)用NaOH溶液调节pH的最佳范围是??????。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是??????????????????????????、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 ????????????????????????。
(二)分析与讨论:
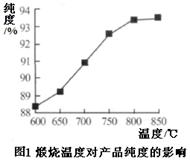 
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在?????℃。
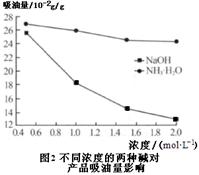
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是???????????????????????。
参考答案:(1)将煤矸石中的矿物转化为氧化物,便于酸浸????(2分)
本题解析:
试题分析:(1)将煤矸石焙烧2小时,反应充分,可将煤矸石中的矿物转化为氧化物,便于酸浸。
(2)酸浸后生成Fe2(SO4)3,所以过量H2SO4可以提高浸取率,抑制Fe3+等水解。
(3)根据表中数据,Fe3+完全沉淀时的pH为2.8,而Al3+开始沉淀时的pH为3.3,要使Fe3+完全转化为沉淀而不含杂质,调节pH的最佳范围是2.8≤pH<3.3;继续加碱调pH至12.2,Mg2+完全转化为Mg(OH)2沉淀,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤,可
本题难度:一般
2、填空题 分某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
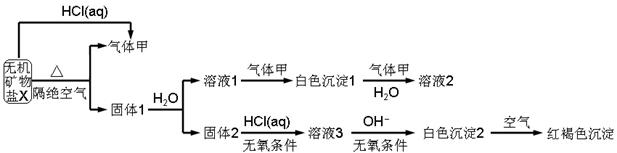
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
参考答案:(1) 本题解析: 本题解析:
试题分析:白色沉淀2在空气中变成红褐色沉淀说明白色沉淀2是Fe(OH)2。溶液1中通入甲气体,有白色沉淀1,再通入甲气体(注意:水存在时)又溶解,甲气体是弱酸性气体,根据X与固体1的质量确定是CO2。
本题难度:一般
3、计算题 (6分) 铁粉和氧化亚铁粉末的混合物共9.2克,加入到150mL的稀硫酸中,恰好完全反应,得到氢气2.24L(标准状况)。求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
参考答案:⑴ Fe:5.6g? FeO:3.6g???? 3分??⑵
本题解析:n=V/Vm=0.1mol
Fe+H2SO4==FeSO4+H2 ↑
1????????????????? 1
n Fe??????????????? 0.1mol
所以n Fe="0.1" mol,mFe=5.6g,? mFeo=9.2g-5.6g=3.6g,? nFeo=0.05mol
溶质为硫酸亚铁,根据铁元素守恒n FeSO4=0.15mol,所以n H2SO4=0.15mol,C H2SO4=1? mol/L
本题难度:一般
4、填空题 (14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是??????? ▲?????。比较第一电离能Cu??? ▲???Zn(填 “>”、“=”、“<”),说明理由?????????? ▲??????????。
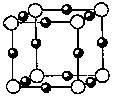
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为?????? ▲??。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为?? ▲ 杂化,与NH3互为等电子体的粒子有?? ▲?。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲? 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。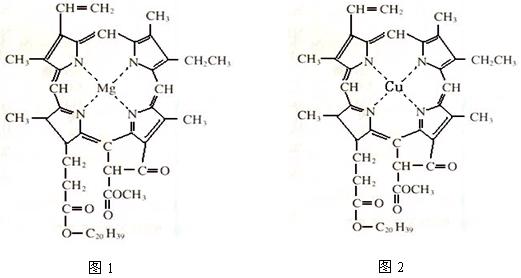
参考答案:(14分)
(1)① 1s22s22p63s23p63
本题解析:略
本题难度:简单
5、填空题 科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
参考答案:(1)稀硫酸和铁粉
(2)杀菌剂(强氧化剂)和吸附剂(
本题解析:(1)FeSO4是强酸弱碱盐,易发生水解使溶液呈酸性,配制溶液时,需加入稀硫酸抑制Fe2+水解,FeSO4具有较强的还原性,还需加入铁粉,防止Fe2+被氧化。
(2)高铁酸钾中铁为+6价,具有很强的氧化性,可用于杀菌,高铁酸钾的还原产物是Fe3+,易水解生成氢氧化铁胶体,具有较强的吸附杂质的能力,可用于净水。
(3)该电池放电时,Zn失电子,为电池的负极,结合产物Zn(OH)2,可写出放电时的负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(
本题难度:困难
|