微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 金属K与Na金属性相近,用金属K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔沸点如下:
A.97.8 ℃~770℃
B.770℃~774℃
C.774℃~882.9℃
D.1413℃~1500℃
参考答案:C
本题解析:(热还原冶炼法)金属活动顺序表中,Na排在钾的后面,似乎不能从钾的熔盐中置换出K。但将Na与KCl共熔,其共熔体中Na+、K+、Cl-和e-自由移动;如果继续加热,则Na、K、NaCl和KCl首先沸腾者逸出无疑。工业上,就是采用这种原理用Na还原K的,因为K的沸点比Na、NaCl、KCl的沸点都低,且高于Na、NaCl、KCl的熔点。
本题难度:一般
2、选择题 下列说法正确的是
A.2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
D.刚玉、红宝石、蓝宝石的主要成分是Al2O3,而青花瓷、石英玻璃、分子筛的主要成分是硅酸盐
参考答案:B
本题解析:分析:A.2013年1月1日起,我省正式发布环境空气质量指数(AQI)包括PM2.5、PM10、臭氧、一氧化碳、二氧化硫和二氧化氮6项;
B.氨基酸中含有氨基和羧基,两者能反应,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度;
C.明矾在溶液中电离出铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水;
D.石英玻璃的主要成分是SiO2,青花瓷、分子筛的主要成分是硅酸盐;
解答:A.2013年1月1日起,我省正式发布环境空气质量指数(AQI)包括PM2.5、PM10、臭氧、一氧化碳、二氧化硫和二氧化氮6项,不含CO2,故A错误;
B.氨基酸中含有氨基和羧基,两者能反应,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度,故B正确;
C.明矾在溶液中电离出铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,但不能杀菌消毒,故C错误;
D.刚玉、红宝石、蓝宝石的主要成分是Al2O3,石英玻璃的主要成分是SiO2,青花瓷、分子筛的主要成分是硅酸盐,故D错误;
点评:本题是一道综合性题目,涉及知识点较多,难度不大,注意相关知识的积累.
本题难度:困难
3、选择题 U(铀)是重要的核工业原料,常见化合价有+4和+6。硝酸铀酰[UO2(NO3)2]加热可发生如下分解:?UO2(NO3)2→UXOY+NO2↑+O2↑。在600K时,收集满一试管气体产物,并将试管倒扣于水中,气体全部被吸收,水充满试管。则生成铀的氧化物中铀元素的化合价是
A.+4
B.+6
C.+4和+6
D.0
参考答案:B
本题解析:由4NO2 +O2 +2H2O = 4HNO3可知,气体全部被吸收,NO2和O2体积比为4:1,根据2UO2(NO3)2→UXOY+4NO2↑+O2↑推知x=2,y=6,U为+6价。
本题难度:简单
4、选择题 已知:①2Na(s)+1/2O2(g)→Na2O(s)+414kJ;②2Na(s)+O2(g)→Na2O2(s)+511kJ下列判断正确的是
A.当生成等物质的量的产物时,反应①和②转移电子数相同
B.2Na(g)+O2(g)→Na2O2(s)+Q?kJ,Q<511kJ
C.46g钠与16g氧气反应生成62g氧化钠,能放热414?kJ
D.Na2O2和Na2O均能与水反应生成NaOH,故均是碱性氧化物
参考答案:A
本题解析:分析:A.由钠原子的个数及钠元素的化合价分析转移的电子数;
B.同一物质中,气态物质含有的能量大于固态含有的能量;
C.先进行过量计算,再根据量少的为标准计算,注意物质的状态不同,放出的热量不同;
D.和水反应只生成碱的氧化物是碱性氧化物.
解答:A.由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,故A正确;
B.2Na(s)+O2(g)=Na2O2(s)△H=-511kJ?mol-1,气态钠的能量大于固态钠的能量,所以2Na(g)+O2(g)→Na2O2(s)+Q?kJ,Q>511kJ,故B错误;
C.46g钠的物质的量=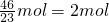 ,氧气的物质的量=
,氧气的物质的量= ,根据方程式2Na(s)+1/2O2(g)→Na2O(s)+414kJ知,钠和氧气恰好完全反应,但氧化钠的状态未知,所以放出的热量不一定是414?kJ,故C错误;
,根据方程式2Na(s)+1/2O2(g)→Na2O(s)+414kJ知,钠和氧气恰好完全反应,但氧化钠的状态未知,所以放出的热量不一定是414?kJ,故C错误;
D.过氧化钠和水反应生成氢氧化钠和氧气,所以过氧化钠不是碱性氧化物,故D错误;
故选A.
点评:本题考查钠及其化合物的性质,注意反应热与物质的状态有关,为易错点.
本题难度:简单
5、选择题 有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是
A.甲=丙>乙
B.丙>乙>甲
C.乙>甲=丙
D.甲=乙=丙
参考答案:D
本题解析:由题给条件,可知将甲蒸发掉一半水分,溶质的量并未发生变化,故完全反应时消耗的盐酸应与丙相同,甲丙很容易判断.由于存在如下关系式:2NaOH~Na2CO3~2HCl,可知向乙中通入量CO2后部分NaOH变为Na2CO3,而生成的Na2CO3在与盐酸反应时会消耗与NaOH变质前等量的盐酸,故完全反应后,所需盐酸溶液的体积应是相等的,即甲=乙=丙.
本题难度:困难