微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中,不能由化合反应制得的是????????????????????????????(???? )
A.Fe(OH)3
B.FeCl2
C.Fe(OH)2
D.FeCl3
参考答案:C
本题解析:
试题分析:氢氧化铁和氧气以及水反应即得到氢氧化铁,该反应是化合反应;氯化铁和铁化合即得到氯化亚铁;铁在氯气中燃烧即生成氯化铁。其中氢氧化亚铁不可能通过化合反应得到,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,侧重对学生基础知识的巩固和检验。有利于培养学生的应试能力,提高学生的学习效率和学习积极性。
本题难度:简单
2、选择题 下列气体中,既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是( )
A.Cl2
B.SO2
C.H2
D.NH3
参考答案:A.氯气能够与氢氧化钠反应,不能使用氢氧化钠固体干燥氯气,故
本题解析:
本题难度:简单
3、简答题
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
?
| ?
|
?
| 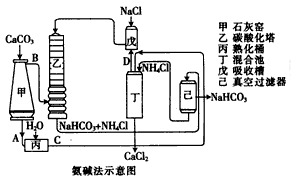
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
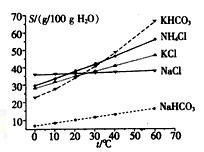
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
参考答案:(1)①2NaCl+H2SO4(浓)  本题解析:(1)由题目信息可知,① 食盐与浓硫酸加热生成硫酸钠和HCl,不加热生成硫酸氢钠和HCl,2NaCl+H2SO4(浓) 本题解析:(1)由题目信息可知,① 食盐与浓硫酸加热生成硫酸钠和HCl,不加热生成硫酸氢钠和HCl,2NaCl+H2SO4(浓)  Na2SO4+2HCl↑②硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成, Na2SO4+2HCl↑②硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,
故反应方程式为:Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO CaS+Na2CO3+4CO
或Na2SO4+2C+CaCO3 CaS+Na2CO3+2CO2 CaS+Na2CO3+2CO2
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3。
②、氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl。
(3)能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3制 CO2这一工序。
(4)不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl。
不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl
本题难度:一般
4、实验题 (15分)
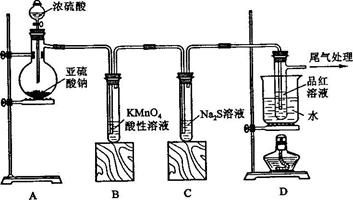
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是?????????????,其中发生反 应的化学方程式为???????????; 应的化学方程式为???????????;
(2)实验过程中,装置B、C中发生的现象分别是??????????、??????????,这些现象分别说明SO2具有的性质是?????????和??????????;装置B中发生反应的离子方程式
为????????;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象????????????????????????????;
(4)尾气可采用 ????????????溶液吸收。 ????????????溶液吸收。
参考答案:
(1) 本题解析:略 本题解析:略
本题难度:简单
5、实验题 (14分)实验室用固体烧碱配制500mL 1 mol/L的NaOH溶液
(1)(4分)需称量???????g的烧碱固体,固体应放在????????中称量。
(2)(4分)配制过程中除了烧杯还需要哪些仪器???????????????????????????????????
???????????????????????????????????
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低或无影响)(4分)
①定容时俯视刻度线?????????????????②容量瓶未干燥?????????????????
③转移过程中有少量液体溅出??????????????
④未洗涤烧杯和玻璃棒???????????????????????????
(4)(2分)若定容时液面高于刻度线应采取的措施是?????????????????????????
参考答案:(1)(每空2分)20.0g?????小烧杯
(2)(
本题解析:考查一定物质的量浓度的配制。
(1)根据物质的量浓度的概念可知,需要氢氧化钠的物质的量为0.5L×1mol/L=0.5mol,其质量是0.5mol×40g/mol=20.0g.氢氧化钠易潮解,称量时要放在小烧杯中称量。
(2)称量需要托盘天平,溶解需要玻璃棒,定容需要500ml容量瓶和胶头滴管。
(3)①导致容量瓶中的溶液体积偏小,结果偏高。②不影响。③导致溶质的物质的量减少,结果偏低。④导致溶质的物质的量减少,结果偏低。
(4)定容时液面一旦高于刻度线,则结果偏低,即实验已经失败,需要重新配制。
本题难度:一般
|