微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验可行的是[???? ]
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
D.用乙醇从碘水中萃取碘?
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列各组物质中,所含分子数目相同的是
A.10gH2和10gO2
B.9gH2O和0.5molBr2
C.224mLH2(标准状况)和0.1molN2
D.5.6LN2和11gCO2
参考答案:B
本题解析:分析:A.根据n=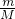 计算氢气、氧气的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
计算氢气、氧气的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
B.根据n=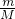 计算水的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
计算水的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
C.根据n=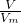 计算氢气物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
计算氢气物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
D.未指明氮气所处的状态,气体摩尔体积不一定是22.4L/mol.
解答:A.10gH2的物质的量=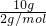 =5mol,10gO2的物质的量=
=5mol,10gO2的物质的量=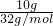 =
=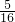 mol,二者物质的量不相等,含有的分子数目不相等,故A错误;
mol,二者物质的量不相等,含有的分子数目不相等,故A错误;
B.9gH2O的物质的量=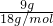 =0.5mol,与0.5molBr2的物质的量相等,含有的分子数目相等,故B正确;
=0.5mol,与0.5molBr2的物质的量相等,含有的分子数目相等,故B正确;
C.224mLH2(标准状况)的物质的量=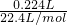 =0.01mol,与0.1molN2的物质的量不相等,二者含有的分子数目不相等,故C错误;
=0.01mol,与0.1molN2的物质的量不相等,二者含有的分子数目不相等,故C错误;
D.未指明氮气所处的状态,气体摩尔体积不一定是22.4L/mol,物质的量不一定是0.5mol,二者物质的量不一定相等,根据N=nNA可知,二者含有分子数目不一定相等,故D错误;
故选B.
点评:本题考查常用化学计量的有关计算,难度不大,注意对公式的理解与灵活运用,注意气体摩尔体积的使用条件与对象.
本题难度:一般
3、选择题 能够直接鉴别BaCl2、NaCl、Na2CO3三种溶液的试剂是(??)
A.AgNO3溶液
B.稀硫酸
C.稀盐酸
D.稀硝酸
参考答案:B
本题解析:
试题分析:A、BaCl2、NaCl、Na2CO3与AgNO3溶液反应都生成沉淀,无法鉴别;B、稀硫酸与BaCl2反应生成沉淀,稀硫酸与Na2CO3反应生成气体,稀硫酸与不NaCl反应,现象不同,可鉴别;C、稀盐酸和BaCl2、NaCl不反应,无法鉴别BaCl2、NaCl;D、稀硝酸与BaCl2、NaCl不反应,无法鉴别BaCl2、NaCl。
本题难度:一般
4、选择题 8 g无水硫酸铜配成0.1 mol·L-1的水溶液,则下列说法正确的是(???)
A.溶于500 mL水中
B.溶解后得到500 mL溶液
C.从中取出100 mL溶液,其浓度为0.02 mol·L-1
D.从中取出1 mL溶液,其浓度为0.01 mol·L-1
参考答案:B
本题解析:8 g无水硫酸铜n(CuSO4)="8" g/160 g·mol-1="0.05" mol,溶液的体积
="0.05" mol/0.1 mol·L-1="500" mL。
本题难度:简单
5、选择题 下列各组液体混合物,用分液漏斗不能分开的是(???)
A.水与煤油
B.氯乙烷和水
C.苯和水
D.乙醇和乙酸
参考答案:D
本题解析:
试题分析:只有互不相溶的液体之间才能用分液漏斗进行分离,据此可知选项ABC都是可以的。D中乙醇和乙酸互溶,所以不能用分液漏斗进行分离,答案选D。
点评:分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:①分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶);②分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏;③分离提纯物是胶体:盐析或渗析;④分离提纯物是气体:洗气。
本题难度:简单