微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在无色溶液中一定能大量共存的离子组是
A.K+、Ca2+、Cl-、SO42-
B.K+、AlO2-、Cl-、CO32-
C.Na+、OH-、MnO4-、HCO3-
D.H+、Fe2+、SO42-、ClO-
参考答案:B
本题解析:分析:根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存.本题还要注意溶液呈无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答:A、Ca2+和SO42-形成的硫酸钙是微溶物,浓度大时可以浑浊,所以溶液不一定澄清;故A不符合;
B、K+、AlO2-、Cl-、CO32-离子间不反应,水溶液中可以共存,故B符合;
C、Na+、OH-、MnO4-、HCO3-中MnO4-离子是紫红色溶液,OH-和HCO3-中反应生成水和碳酸根离子,故C不符合;
D、H+、Fe2+、SO42-、ClO- 中Fe2+是浅绿色溶液,H+、Fe2+、ClO- 之间发生氧化还原反应,故D不符合;
故选B.
点评:本题考查了离子性质的应用,主要是有色离子在无色溶液中不存在,离子反应是判断的依据,题目难度中等.
本题难度:困难
2、选择题 离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3-的摩尔电导率分别为0.60、1.98、0.45,据此可判断,往饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是
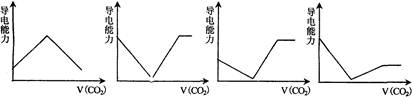
A. B.???????????C. ???????????D.
参考答案:D
本题解析:
试题分析:饱和的澄清石灰水中通入过量的CO2前,溶液中有Ca2+、OH-,通入过量CO2之后,溶液中为Ca2+、HCO3-,前者溶液的导电能力更强,故B、C选项错误;通入足量的CO2,Ca2+与CO2全部生成碳酸钙沉淀,此时导电能力最小,故A选项错误;通入过量CO2后,溶液溶质为碳酸氢钙,再通入气体,对电导率的影响较小,曲线上升趋势很小,故D选项正确。
点评:本题所考查的虽欲电导率相关,但实际考查的是学生对与反应物量相关的反应的掌握,同时注意题目和图形相结合来解答。
本题难度:简单
3、选择题 下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是(????)
①向饱和碳酸钠溶液中通入过量CO2????②向Fe(OH)3胶体中逐滴加入过量稀盐酸;
③向AgNO3溶液中逐滴加入过量氨水;?④向硅酸钠溶液中逐滴加入过量的盐酸
A.①②
B.①④
C.①③
D.②③
参考答案:B
本题解析:
试题分析:①向饱和碳酸钠溶液中通入过量CO2??,先生成碳酸钙沉淀,然后又转化为碳酸氢钙是可溶的物质,所以会先产生沉淀,然后沉淀又溶解?②向Fe(OH)3胶体中逐滴加入过量稀盐酸,首先是胶体的聚沉,然后是酸碱中和反应,所以会先产生沉淀,然后沉淀又溶解;③向AgNO3溶液中逐滴加入过量氨水; 产生沉淀氧化银 ④向硅酸钠溶液中逐滴加入过量的盐酸 ,只能得到硅酸,不会消失;故选B。
点评:本题考查的知识均源自于课本,学生一定要熟悉基本的课本知识,多积累这方面的知识,此题便不难解决。
本题难度:一般
4、选择题 下列各组离子,加入盐酸或NaOH溶液都能大量共存的是
A.Al3+、K+、AlO2-、Cl-
B.Ba2+、Na+、Cl-、SO42-
C.Na+、Cl-、SO42-、I-
D.Na+、K+、Ag+、NO3-
参考答案:C
本题解析:
本题难度:困难
5、选择题 如限定使用以下的物质:盐:钾盐、钠盐、铵盐、钡盐 酸:盐酸、硝酸、醋酸、稀硫酸 那么,符合:
2H++SO32-=SO2↑+H2O 这个离子方程式的化学反应式共有 [???? ]
A. 6个
B. 9个
C. 12个
D. 15个
参考答案:D
本题解析:
本题难度:简单