微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关热化学方程式的叙述正确的是( )
A.已知C(石墨,s) C(金刚石,s);△H>0,则金刚石比石墨稳定
C(金刚石,s);△H>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g);△H1和C(s)+1/2O2(g)=CO(g);△H2,则△H1>△H2
C.101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-5716kJ/mol,则氢气的燃烧热为285.8kJ/mol
D.含20.0gNaOH的稀溶液与稀盐酸完全中和时放出28.7kJ的热量,则该反应的热化学方程式为: NaOH(aq)+HCl(aq)="NaCl(aq)+" H2O(1);△H="+57.4" kJ/mol
参考答案:C
本题解析:
试题分析:A、由反应:C(石墨,s) C(金刚石,s);△H>0知,石墨具有的能量低,物质具有的能量越低越稳定,则石墨比金刚石稳定,错误;B、△H大小比较要带符号比较,对于放热反应而言,放出的热量越多,△H越小,则△H1<△H2,错误;C、101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-5716kJ/mol,则氢气的燃烧热为285.8kJ/mol,正确;D、含20.0gNaOH的稀溶液与稀盐酸完全中和时放出28.7kJ的热量,则该反应的热化学方程式为: NaOH(aq)+HCl(aq)="NaCl(aq)+" H2O(1);△H=—57.4 kJ/mol,错误。
C(金刚石,s);△H>0知,石墨具有的能量低,物质具有的能量越低越稳定,则石墨比金刚石稳定,错误;B、△H大小比较要带符号比较,对于放热反应而言,放出的热量越多,△H越小,则△H1<△H2,错误;C、101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-5716kJ/mol,则氢气的燃烧热为285.8kJ/mol,正确;D、含20.0gNaOH的稀溶液与稀盐酸完全中和时放出28.7kJ的热量,则该反应的热化学方程式为: NaOH(aq)+HCl(aq)="NaCl(aq)+" H2O(1);△H=—57.4 kJ/mol,错误。
考点:考查化学反应的焓变、燃烧热的概念及热化学方程式的书写。
本题难度:一般
2、填空题 (12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
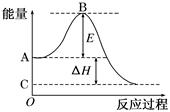
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示: &# 160; _____;C点表示: (填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
参考答案:(1)反应物的总能量;生成物的总能量(2)无 (3
本题解析:(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义。
(2)E为活化能与反应热无关,但是用催化剂可以降低活化能。
(3)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1=-198kJ/mol
本题难度:一般
3、选择题 下列各图所表示的反应是吸热反应的是( )

A B C D
参考答案:A
本题解析:反应物的总能量小于生成物的总能量,则反应就是吸热反应,所以答案选A。
本题难度:一般
4、选择题 S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜, s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定
参考答案:C
本题解析:
试题分析:A、根据盖斯定律,反应①减反应②,则反应热="-297.16+296.83=-0.33" kJ·mol-1,不选A;B、ΔH3<0,所以反应为放热,不选B;C、放热反应,生成物稳定,所以正交硫稳定,正确,选C;D、反应放热,不选D。
考点:盖斯定律
本题难度:一般
5、选择题 将气体A2和B2以等物质的量充入密闭容器,一定条件下发生反应生成C气体。平衡时测得c(A2)= 0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则C的分子式为
A.AB????????????B.AB2??????????????C.A2B??????????? D.A2B3
参考答案:BD
本题解析:
试题分析:开始A2和B2两种气体的浓度相等,设均为x mol/L。在密闭容器内反应生成气体C,达平衡后,测得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L,故△c(A2)="x" mol/L-0.58mol/L,△c(B2)="x" mol/L-0.16mol/L,△c(C)=0.84mol/L,A、如果C的分子式为AB,则x mol/L-0.58mol/L=x mol/L-0.16mol/L,显然不符合题意,A不正确;B、如果C的分子式为AB2,则
本题难度:一般