微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列晶体熔化时化学键没有被破坏的是
A.NaCl
B.冰醋酸
C.金刚石
D.Al
参考答案:B
本题解析:
本题难度:简单
2、选择题 4.0g氢氧化钠溶于100ml水,充分振荡后,氢氧化钠溶液的物质的量浓度是1mol/L
A.小于
B.等于
C.大于
D.无法判断
参考答案:A
本题解析:4.0g氢氧化钠的物质的量是4.0g÷40g/mol=0.1mol。由于溶液的体积大于0.1L,所以根据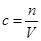 可知,选项A正确,答案选A。
可知,选项A正确,答案选A。
本题难度:简单
3、选择题 镁铝合金5.1g完全溶于过量的热浓硝酸中,反应中共产生11.2 LNO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀质量为
A.13.6 g
B.7.8g
C.5.8g
D.4g
参考答案:C
本题解析:设合金中镁和铝的物质的量分别是x和y,NO2是0.5mol,所以根据电子的得失守恒可知,金属失去电子的物质的量是0.5mol,则2x+3y=0.5mol。又因为24x+27y=5.1g,所以解得x=y=0.1mol。氢氧化铝是两性氢氧化物,所以最终生成的沉淀是氢氧化镁,其质量5.8g,答案选C。
本题难度:简单
4、选择题 除去SiO2固体中混有的CaCO3固体,方法正确的是
A.加水,过滤
B.加热
C.加盐酸,过滤
D.加NaOH溶液,过滤
参考答案:C
本题解析:碳酸钙与酸反应,二氧化硅只与氢氟酸反应,因此可加盐酸,然后过滤除去杂质.
本题难度:简单
5、选择题 与30mL?1mol/L的MgCl2溶液中Cl-浓度相同的是
A.150mL?0.2mol/L?FeCl2溶液
B.90mL?2mol/L?NaCl溶液
C.60mL?1mol/LAlCl3溶液
D.30mL?0.5mol/L?CaCl2溶液
参考答案:B
本题解析:分析:电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,1mol/L的MgCl2溶液中Cl-浓度为2mol/L,据此结合选项判断.
解答:1mol/L的MgCl2溶液中Cl-浓度为2mol/L,
A、150mL?0.2mol/L?FeCl2溶液中Cl-浓度为0.2mol/L×2=0.4mol/L,故A不符合;
B、90mL?2mol/L?NaCl溶液中Cl-浓度为2mol/L×1=2mol/L,故B符合;
C、60mL?1mol/LAlCl3溶液中Cl-浓度为1mol/L×3=3mol/L,故C不符合;
D、30mL?0.5mol/L?CaCl2溶液中Cl-浓度为0.5mol/L×2=1mol/L,故D不符合;
故选B.
点评:本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算.
本题难度:简单