微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)实验室里通常用 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) ??△??MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是??????mol,转移电子的物质的量是??????????mol 。
mol Cl2生成,被氧化的HCl的物质的量是??????mol,转移电子的物质的量是??????????mol 。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到的混合液中ClO- 与ClO3- 物质的量之比为1∶1 ,反应的化学方程式是????????????????????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、填空题 欲探究氯气与碘单质的氧化性强弱,某同学设计了如下装置(用浓盐酸和KMnO4固体反应制取氯气)。
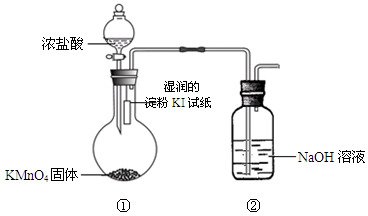
请回答:
(1)实验中观察到湿润的淀粉KI试纸????????,写出其中发生的置换反应的离子方程式: ?????????????????????????????????????????????????。
(2)实验结论:氯单质的非金属性比碘单质的?????(填“强”或“弱”)。从原子结构角度解释:氯和碘位于周期表中??????族,该族元素从上到下,????????????????????,得电子能力减弱。
(3)装置②的作用是???????????????????????????????。
写出相应的化学方程式:???????????????????????????????????
参考答案:(12分)(1)试纸 变蓝,Cl2 +2 I-=I2+ 2C
本题解析:
试题分析:(1)装置①中可以生成氯气,氯气具有强氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,反应的离子方程式是Cl2 +2 I-=I2+ 2Cl-。
(2)根据强者可以置换弱者可知,氯单质的非金属性比碘单质的强。这是由于氯和碘位于周期表中的第ⅦA族,该族元素从上到下,原子半径逐渐增大,得电子能力减弱。
(3)氯气有毒,所以装置②的作用是尾气吸收装置,吸收多余的氯气,反应的化学方程式是Cl2+2NaOH = NaCl+NaClO+H2O。
点评:该题是基础性实验题的考查,侧重
本题难度:一般
3、选择题 为预防H1N1甲型流感,每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是[???? ]
A. NaClO溶液的消毒原理是使蛋白质变性
B. l mol Cl2与足量NaOH溶液反应转移2mol电子
C. NaClO溶液的漂白原理与NaO2、SO2相同
D. “84”消毒液不能与“洁厕灵”(盐酸)共同使用
参考答案:BC
本题解析:
本题难度:简单
4、选择题 四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满Cl2的试管是(??)
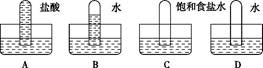
参考答案:C
本题解析:四种气体中,只有NH3极易溶于盐酸,所以A为NH3;NO2溶于水时发生反应3NO2+H2O=2HNO3+NO,所以B为NO2;Cl2在饱和食盐水中的溶解度很小,所以C为Cl2;只有O2不溶于水,所以D为O2。
本题难度:一般
5、计算题 将一定量的氯气通入250 mL溴化钾溶液中,然后将所得的溶液蒸干,并将残渣灼烧,得到干燥的残渣40 g,分析残渣,其中含25%的化合态的溴,试计算:
(1)通入的一定量的氯气是多少克?(氯气无剩余)
(2)原溴化钾溶液含KBr多少克?
参考答案:(1)11.97 g? (2)55.01 g
本题解析:溴化钾溶液中通入氯气,必然会产生氯化钾和溴,由已知25%的化合态的溴可设法求出溴化钾的质量,从而求出40 g残渣中氯化钾的质量,再根据化学反应方程式将氯化钾当成已知量以求算通入的氯气是多少克,并求原溶液中的溴化钾为多少克。搞清残渣成分和正确换算是关键。
40 g残渣中所含Br-的质量为:40 g×25%="10" g。求KBr的质量:由Br—KBr的质量比:80∶119得KBr的质量=10×119÷80="14.87" g。设x g Cl2与y g KBr反应生成了25.13 g KCl,则
本题难度:简单