微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 北京奥运会所颁发的“金镶玉”奖牌,将青海软玉创造性地运用于奥运奖牌之上,蕴含着“以玉比德”的理念,中国特色浓厚,艺术风格典雅。青海软玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,“透闪石”的化学成分为Ca2Mg5Si8O22(OH)2。下列有关说法不正确的是:
A.“透闪石”的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O
B.“透闪石”中Mg元素的质量分数是Ca元素质量分数的2倍
C.“透闪石”的化学式写成硅酸盐的形式为:2CaSiO3·5MgSiO3·H2SiO3
D.“透闪石”不耐热,也不耐酸腐蚀
参考答案:B
本题解析:根据“透闪石”的化学式可知,1mol透闪石”中Mg元素和Ca元素的质量分别分5mol×24g/mol=120g,2mol×40g/mol=80g,因此二者的质量之比是3︰2,即选项B不正确。答案是B。
本题难度:一般
2、选择题 卤族元素随原子核电荷数的增加,下列叙述不正确的是()
A.原子半径依次增大
B.元素的非金属性依次减弱
C.单质的氧化性依次减弱
D.氢化物的稳定性依次增强
参考答案:D
本题解析:卤族元素随着原子核电荷数的增加,电子层数逐渐增加,因此原子半径逐渐增大;因此原子核对最外层电子的吸引力逐渐减弱,元素的原子得电子的能力逐渐减弱,因此元素的非金属性逐渐减弱,单质的氧化性逐渐减弱。具体表现为:①与氢气发生化合反应:由易到难(反应由F2与H2不需要任何条件,到H2与I2加热才化合,并且化合生成的HI同时分解),生成氢化物的稳定性逐渐减弱。当它们的氢化物溶于水时,溶液酸性逐渐增强就成为必然。②卤素单质与水的反应由易到难:F2与水剧烈反应,生成氟化氢和氧气,而I2与水只能微弱反应。③卤素单质之间能
本题难度:简单
3、选择题 下列物质中,不能用做漂白剂的是(?)。
A.SO2
B.Ca(ClO)2
C.NaClO
D.H2SO4(浓)
参考答案:D
本题解析:浓硫酸不具备漂白的特性,只有强氧化性,酸性,腐蚀性,所以答案选D。
本题难度:简单
4、填空题 Cl2与水作用的方程式:????????????????????????。氯水是???????色,说明氯水中含有的粒子:??????????????????????。
参考答案:Cl2+H2O? HClO+HCl???。浅黄绿?,氯气分子
本题解析:Cl2与水作用的方程式:Cl2+H2O? HClO+HCl。氯水中因含有氯分子而使溶液显浅黄绿色;
本题难度:简单
5、填空题 某校化学研究性学习小组对氯气的性质和用途进行了调查分析,了解了氯气能应用 于衣物漂白、水体的杀菌和消毒的原理。
(1) 氯气溶于水可用于漂白、消毒的原因是_______,反应的离子方程式为_______ ;
(2) 通常使用漂白液(NaClO溶液)作漂白剂而不用氯气的理由是_____(写出一项即可);
(3) 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应 (发生的反应均为放热反应)。最终生成物中含有Cl-、 ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离 子的物质的量(n)与反应时间(t)的变化曲线如下图所示。
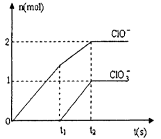
①O-t1时间内,Ca(OH)2与Cl2发生反应的化学方程式为_______;
②t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_______
③该石灰乳中含有Ca(OH)2的质量是_______g;
参考答案:(9分)
(1)氯气和水反应生成强氧化性的次氯酸(1分
本题解析:
试题分析:(1)氯气和水反应生成次氯酸,次氯酸具有很强的氧化性,故氯气溶于水可用于漂白、消毒的原因是氯气和水反应生成强氧化性的次氯酸,反应的离子方程式为Cl2+H2O=HClO+H++ClO-。
(2)氯气有毒,且不容易使用,故通常使用漂白液(NaClO溶液)作漂白剂而不用氯气的理由是NaClO更稳定,便于储存和运输。
(3) ①由图像分析,t1时刻没有ClO3-离子生成,故O-t1时间内,Ca(OH)2与Cl2发生反应的化学方程式为2Ca(OH)2+2Cl2=Ca(C1O)2+CaC
本题难度:一般