微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在1L?1mol/L的氨水中,下列有关说法正确的是[???? ]
A.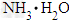 为1mol?,溶质质量为35g
为1mol?,溶质质量为35g
B.NH4+为1mol?,溶质质量为18g
C.溶解状态的NH3分子为1mol,溶质质量为17g
D.氨水中NH3、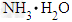 、NH4+三种微粒总的物质的量为1mol?
、NH4+三种微粒总的物质的量为1mol?
参考答案:D
本题解析:
本题难度:简单
2、计算题 浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下)。已知:
Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。试计算:
CuSO4+SO2↑+2H2O。试计算:
(1)反应中消耗的铜的质量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中CuSO4的物质的量浓度是多少?
参考答案:(1)9.6g
本题解析:
试题分析:假设消耗铜的质量为m克,则根据方程式列式计算:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
1 22.4
m n 3.36
64/m=22.4/3.36 m=9.6g
1/n=22.4/3.36 n="0.15mol"
硫酸铜的浓度=0.15/0.5=0.3mol/L。
考点:化学方程式的计算,物质的量浓度。
本题难度:一般
3、填空题 (4分)硫酸和硝酸是中学阶段常见的两种强酸,请就两者与金属铜的反应情况回答下列问题:
(1)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是? ???(填写代号):
A.7.32L
B.6.72L
C.20.16L
D.30.24L
(2)若使上述反应中剩余的铜片继续溶解,可将溶液稀释并向其中加入硝酸钠,写出反应的离子方程式?? ??????????????????。
参考答案:(共4分)(1)AB??(2)3Cu+8H++2NO3-=3
本题解析:
试题分析:(1)浓硫酸中溶质的物质的量是1.8mol,浓硫酸和铜反应的化学方程式是
Cu+2H2SO4(浓)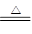 CuSO4+SO2↑+2H2O,所以理论上应该生成SO2的物质的量是0.9mol,标准状况下的体积是20.16L。但由于在反应过程中,浓硫酸的浓度会逐渐降低,所以实际生成的SO2气体的体积小
CuSO4+SO2↑+2H2O,所以理论上应该生成SO2的物质的量是0.9mol,标准状况下的体积是20.16L。但由于在反应过程中,浓硫酸的浓度会逐渐降低,所以实际生成的SO2气体的体积小
本题难度:一般
4、选择题 混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为
A.1:1
B.1:4
C.4:1
D.1:2
参考答案:B
本题解析:混合气体在标准状况下的密度为0.821g/L,则混合气体平均相对分子质量是0.821×22.4=18.4。根据十字交叉法可知,混合气体中N2和CH4的体积之比为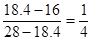 ,所以答案选B。
,所以答案选B。
本题难度:一般
5、选择题 下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 KCl溶液
D.75 mL 1 mol·L-1 AlCl3溶液
参考答案:C
本题解析:
试题分析:50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度为1mol/Lx2=2mol/L,浓度与溶液的体积无关,150 mL 1 mol·L-1 NaCl溶液,氯离子浓度为1mol/L,A错误;B.75 mL 2 mol·L-1 CaCl2溶液,氯离子浓度为2mol/Lx2=4mol/L,B错误;150 mL 2 mol·L-1 KCl溶液,氯离子浓度为2mol/L,C正确;75 mL 1 mol·L-1 AlCl3溶液,氯离子浓度为3mol/L,D错误,答案选C.
考点:物质的量浓度的有关计算
本题难度:一般