微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在100mL某混合溶液中,c(HNO3)="0.4" mo/lL、c(H2SO4)="0.1" mol/L,向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu2+)为
A.0.15mol/L
B.0.225mo1/L
C.0.3mo1/L
D.无法计算
参考答案:B
本题解析:
试题分析:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,
n(NO3-)n=0.4mol/L×0.1L=0.04mol.1.92g铜的物质的量为1.92g/64g/mo=0.03mol;
硝酸和铜反应的离子方程式如下:3Cu+8H++2NO3-=3Cu2++2NO+3H2O???????
3Cu~8H+~2NO3-~3Cu2+.0.03mol????0.08mol??????0.02mo
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.18g重水(D2O)所含的电子数为10NA
B.22.4LCl2通入水中充分反应,共转移NA个电子
C.1L 1mol·L-1 NaF溶液中Fˉ的数目小于NA
D.25℃ 时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
参考答案:C
本题解析:
试题分析:A.18g重水(D2O)的物质的量是18g÷20g/mol=0.8mol,所含的电子数为9NA,A错误;B.22.4LCl2通入水中充分反应,不一定转移NA个电子,因此氯气不一定处于标准状况下,22.4L氯气的物质的量不一定是1mol,B错误;C.氟离子在溶液中水解,因此1L 1mol·L-1 NaF溶液中Fˉ的数目小于NA,C正确;D.25℃ 时,pH=13的1.0L Ba(OH)2溶液中氢氧根的浓度是0.1mol/L,其中含有的OH-数目为0.1NA,D错误,答案选C。
考点:考查阿伏伽德罗常数的计算
本题难度:困难
3、选择题 在配制一定物质的量的浓度的盐酸溶液时,下列错误操作可能使所配溶液浓度偏高的是( )
A.未将烧杯和玻璃棒的洗涤液移入容量瓶
B.溶解搅拌时液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
参考答案:解;A、未将烧杯和玻璃棒的洗涤液移入容量瓶,导致质的物质的量
本题解析:
本题难度:一般
4、计算题 (12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是:??????、?????????和吸收塔;为了避免酸雾的形成,提高SO3的吸收率,工业上常用????????????????????来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号
| 样品的质量/g
| NaOH溶液的体积/mL
| 氨气的体积/L
|
1
| 3.62
| 50.00
| 0.896
|
2
| 7.24
| 50.00
| 1.792
|
3
| 10.86
| 50.00
| 2.016
|
4
| 14.48
| 50.00
| 1.568
(1)由第1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)
为?????????????L。
(2)14.48g该混合物中n((NH4)2SO4)=??????????mol?? n(NH4HSO4)=??????????mol
(3)第4组中过量的NH4+ 的物质的量为:????????????mol
参考答案:I、沸腾炉?接触室?? 98.3%的浓硫酸
II、(1
本题解析:由题给数据,第2组样品质量是第1组的2倍,产生NH3体积也是第1组的2倍;第3组样品质量是第1组的3倍,但产生NH3体积小于第1组的3倍,则NaOH溶液在第1、2组中足量,在第3组中不足。
(1)用1.81 g样品进行实验,NaOH过量,产生的NH3体积应为第1组的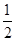 ,即生成NH3的体积为0.448 L。< ,即生成NH3的体积为0.448 L。<
本题难度:一般
5、选择题 NA为阿伏加德罗常数,下列叙述正确的是
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
B.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
C.5.6g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
D.1mol过氧化氢分子中共用电子对数为3NA
参考答案:D
本题解析:正确的是D
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1Na,不正确,没有体积,无法计算。
B.22.4LCH4和CH3Cl的混合物所含有的分子数目为Na,不正确,应在标准状况下。
C.5.6g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA,不正确,0.1mol氯气只能得到0.2 Na的电子。
 本题难度:一般 本题难度:一般
|