微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在恒容密闭容器进行的可逆反应:MgSO4(s) + CO(g)  ?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
?MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
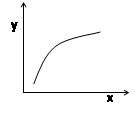
A.若平衡常数K值变大,平衡移动时v逆先减小后增大
B.容器中固体物质的质量不再改变,则反应到达平衡状态
C.若x表示温度,y可表示平衡时混合气体的密度
D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比
参考答案:BC
本题解析:
试题分析:该反应为正方向体积增加且吸热,A.若平衡常数K值变大,平衡右移,v逆增大,错误;B.容器中固体物质的质量不再改变,说明生成量和消耗量相等,则反应到达平衡状态,正确;C、升高温度,平衡正向移动,气体的质量增加,密度增大,正确;增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故D错误;
本题难度:一般
2、选择题 、反应A(g)+3B(g) 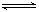 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol / (L·s) B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s) D.υ(A)="0.15" mol / (L·s)
参考答案:B
本题解析:
试题分析:比较反应速率大小要注意统一单位和表示的物质统一。所以在反应A(g)+3B(g) 2C(g)+2D(g)中,以D项υ(A)="0.15" mol / (L·s)为参考标准,则A项υ(D)="0.4" mol / (L·s)转化为υ(A)="1/2υ(D)=0.2" mol / (L·s),B项υ(C)="0.5" mol / (L·s)转化为υ(A)="1/2υ(C)=0.25mol" / (L·s),C项υ(B)="0.6" mol / (L·s)转化为υ(A)="1/3υ(B)=0.2" mol / (L·s),所以比较转化以后的υ(A)的大小,可知B最大,所以选B 。
2C(g)+2D(g)中,以D项υ(A)="0.15" mol / (L·s)为参考标准,则A项υ(D)="0.4" mol / (L·s)转化为υ(A)="1/2υ(D)=0.2" mol / (L·s),B项υ(C)="0.5" mol / (L·s)转化为υ(A)="1/2υ(C)=0.25mol" / (L·s),C项υ(B)="0.6" mol / (L·s)转化为υ(A)="1/3υ(B)=0.2" mol / (L·s),所以比较转化以后的υ(A)的大小,可知B最大,所以选B 。
考点:本题考查的是反应速率大小比较。
本题难度:一般
3、选择题 下列有关化学反应速率的说法中,正确的是
A.往容积一定的容器中再通入O2,可以加快反应2SO2+O2 2SO3的反应速率
2SO3的反应速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.对于C(s)+H2O(g)  CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
参考答案:A
本题解析:
试题分析:A、增大反应物的浓度可以加快化学反应速率,正确;B、增大反应物的浓度可以加快化学反应速率,但是铁片遇浓硫酸会发生钝化,错误;C、固体的浓度是一常量,改变固体的用量对反应速率基本没有影响,错误;D、盐酸与锌反应的实质是:Zn + 2H+??= Zn2+ + H2?,加入氯化钠溶液相当于使H+浓度减小,生成氢气的速率减小,错误。
本题难度:一般
4、选择题 某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
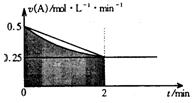
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1至1.5mol·L-1之间
参考答案:C
本题解析:略
本题难度:简单
5、实验题 控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙状态
| c(HCl)/mol·L-1
| 溶液温度/oC
| 碳酸钙消失时间/s
|
反应前
| 反应后
|
1
| 粒状
| 0.5
| 20
| 39
| 400
|
2
| 粉末
| 0.5
| 20
| 40
| 60
|
3
| 粒状
| 0.6
| 20
| 41
| 280
|
4
| 粒状
| 0.8
| 20
| 40
| 200
|
5
| 粉末
| 0.8
| 20
| 40
| 30
|
6
| 粒状
| 1.0
| 20
| 40
| 120
|
7
| 粒状
| 1.0
| 30
| 50
| 40
|
8
| 粒状
| 1.2
| 20
| 40
| 90
|
9
| 粒状
| 1.2
| 25
| 45
| 40
|
分析并回答下列问题:
(1)本反应属于__________反应(填“吸热”或“放热”),反应的离子方程式_____________。
(2)实验6和7表明,___________对反应速率有影响,__________反应速率越快,能表明同一规律的实验还有_____________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是_____________________。
(4)本实验中影响反应速率的其它因素还有________________,能表明这一规律的实验序号是1、2与____________。
参考答案:(1)放热;CaCO3+2H+===Ca2++CO2↑+H2
本题解析:
试题分析:(1)通过表中数据,对比反应前后温度变化可知,反应后溶液温度升高,则反应为放热反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2)由实验6和7、8和9的实验数据可知,温度越高,碳酸钙消失的时间越少,说明温度越高,反应速率越大,,能表明同一规律的实验还有8和9;
(3)实验1、3、4、6、8相同的地方是固体的形状相同,反应前的温度相同,但反应物的浓度依次增大,碳酸钙消失的时间以此减少,说明反应物浓度越大,反应速率越快;
(4)1、2与4、5两组
本题难度:一般