微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 今有如下三个热化学方程式:
H2(g)+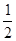 O 2(g)==H2O(g)?ΔH="a" kJ·mol-1;
O 2(g)==H2O(g)?ΔH="a" kJ·mol-1;
H2(g)+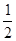 O 2(g)==H2O(l)?ΔH="b" kJ·mol-1;
O 2(g)==H2O(l)?ΔH="b" kJ·mol-1;
2H2(g)+O2(g)====2H2 O(l)???ΔH="c" kJ·mol-1。
关于它们的下列表述正确的是
A.a<b
B.a、b、c均为正值
C.a=b
D.2b=c
参考答案:D
本题解析:氢气的燃烧反应为放热反应,反应热的值为“—”;即B错;由于气态水转化为液态水要放出热量,所以可得a>b,即A错;C错;H2(g)+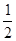 O 2(g)==H2O(l)? ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l)??? ΔH="c" kJ·mol-1的物质的量相差2倍关系,即
O 2(g)==H2O(l)? ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l)??? ΔH="c" kJ·mol-1的物质的量相差2倍关系,即
本题难度:简单
2、选择题 下列反应中,既属于氧化还原反应又属于放热反应的是
A.甲烷在空气中燃烧
B.生石灰与水反应
C.氢氧化钡溶液与硫酸反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
参考答案:A
本题解析:
试题分析:B和C是放热反应,但不是氧化还原反应。D是吸热反应,所以答案选A。
点评:一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。
本题难度:一般
3、选择题 下列有关能量转化的认识不正确的是[???? ]
A.植物的光合作用使太阳能转化为化学能??
B.人类使用照明设备是将电能转化为光能 ??
C.生物体内的化学变化过程在能量转化上常比在体外发生的一些能量转化更为合理,有效?
D.燃料燃烧时只是将化学能转化为热能
参考答案:D
本题解析:
本题难度:简单
4、填空题 (1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
参考答案:(1) 本题解析:(1)1 mol H2SO4与2 mol NaOH反应生成2 mol H2O,放出114.6 kJ热量,故生成1 mol H2O的热化学方程式为
本题解析:(1)1 mol H2SO4与2 mol NaOH反应生成2 mol H2O,放出114.6 kJ热量,故生成1 mol H2O的热化学方程式为
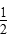 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= 本题难度:一般
本题难度:一般
5、选择题 在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H="a" kJ/mol(a >0),该温度下K = 0.263,下列有关该反应的说法正确的是(???)
A.若生成1 mol Fe,则吸收的热量小于a kJ
B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L
参考答案:D
本题解析:
试题分析:FeO(s)+CO(g) Fe(s)+CO2(g) △H="a" kJ/mol(a >0),即该反应为吸热反应,所以若生成1 mol Fe,则吸收的热量为a kJ,故A错误;若升高温度,正反应速率和逆反应速率都增大,知识正反应速率增大的程度大于逆反应速率,反应向正反应方向进行,所以B错误;
Fe(s)+CO2(g) △H="a" kJ/mol(a >0),即该反应为吸热反应,所以若生成1 mol Fe,则吸收的热量为a kJ,故A错误;若升高温度,正反应速率和逆反应速率都增大,知识正反应速率增大的程度大于逆反应速率,反应向正反应方向进行,所以B错误;
本题难度:简单