微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)氨气是一种重要的基础化工原料,用途广泛。
(1)在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3 + 3H2O2= +6H2O
(2)工业中常用以下反应合成氨:N2+3H2 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。

该反应平衡常数的数学表达式为 ;实验②平衡时H2的转化率为_____ 。
(3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
参考答案:.(16分)
(1)2NH3 + 3H2O2
本题解析:略
本题难度:一般
2、填空题 把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态。分析表中的实验数据后回答有关问题

(1)①②③分别为_________ 、__________ 、__________ 。
(2)都达到平衡时,__________容器的NH3的物质的量所占的比例最大。
(3)四个容器的容积由小到大的顺序是______________ 。
参考答案:(1)10%;6.25%; 12%
(2)A
本题解析:
本题难度:一般
3、选择题 如图所示,反应:X(g)+3Y(g) 2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
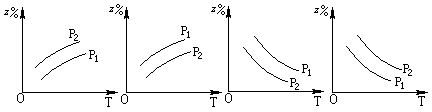
A.??????????????B.??????????? C.????????? D.
参考答案:C
本题解析:
试题分析:根据反应可知,该反应为放热反应,且反应物计量数之和大于生成物计量数。增大压强,Z百分含量应增大,升高温度Z百分含量降低。选项中C图像符合,故选择C选项。
本题难度:一般
4、选择题 对已达化学平衡的下列反应:2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是???[???? ]
2Z(g),减小压强时,对反应产生的影响是???[???? ]
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动??
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动??
C.正、逆反应速率都减小,平衡向逆反应方向移动??
D.正、逆反应速率都增大,平衡向正反应方向移动
参考答案:C
本题解析:
本题难度:一般
5、填空题 化肥是农业生产最基础而且是最重要的物质投入.工业上利用N2和H2合成氨,其化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<0
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1______573K(填“>”、“<”或“=”).
| T/K | T1 | 573 | T2
K
1.00×107
2.45×105
1.88×103
(2)将一定量的N2和H2的混合气放入某密闭容器中发生上述反应.
①下列措施中可提高氢气的转化率的有______(填字母).
A.升高温度????????????????????????B.使用催化剂
C.增大压强????????????????????????D.循环利用和不断补充氮气
②在一定温度和压强下,将H2和N2按体积比3:1在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数为1
7
,此时N2的转化率为______.
(3)某厂每天产生600m3含氨废水(NH3?的浓度为153mg?L-1,废氨水密度为1g?cm-3).该厂处理废水的方法:将废水加热得到NH3,使废水中NH3的浓度降为17mg?L-1.再对加热蒸发得到的NH3用一定量空气氧化.发生的主反应如下:
4NH3+5O2?一定条件?
.
?
4NO+6H2O??????4NO+3O2+2H2O=4HNO3
副反应为:4NH3+3O2=2N2+6H2O
①该厂每天通过加热蒸发可得到NH3的物质的量是多少?
②若氧化过程中90%?NH3转化为硝酸,10%?NH3发生了副反应,则该厂每天消耗标准状况下的空气多少立方米?(假设废水加热前后的体积和密度近似认为不变,空气中氧气的体积分数20%.)
参考答案:(1)该反应的正反应放热,温度升高平衡向逆反应方向移动,T1
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|