微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硝酸生产工艺中,在吸收塔里发生如下反应:3NO2+H2O 2HNO3+NO(正反应为放热反应),为提高NO2的转化率,理论上应该采取的措施是[???? ]
2HNO3+NO(正反应为放热反应),为提高NO2的转化率,理论上应该采取的措施是[???? ]
A.减压
B.增压
C.升温??
D.加催化剂
参考答案:B
本题解析:
本题难度:一般
2、填空题 标准大气压下分别进行如下三个反应:
A.2H2S+3O2=2H2O+2SO2
B.C2H4+3O2=2H2O+2CO2
C.C4H8+6O2=4H2O+4CO2
(1)若反应在容积为V的密闭容器中进行:(ρ为气体的密度)符合ρ(前)=ρ(后),p(前)>p(后)的是_________________;符合ρ(前)=ρ(后),p(前)=p(后)的是______________________ 。
(2)若压强恒定,容积y可变:符合ρ(前)>ρ(后),V(前) V(后)的是______________________。
V(后)的是______________________。
参考答案:(1)A;B
(2)C
本题解析:
本题难度:一般
3、简答题 某温度时,在2L密闭容器中气态物质X和气态物质Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据下表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol
0
1.00
1.00
0.00
1
0.90
0.80
0.20
3
0.75
0.50
0.50
5
0.65
0.30
0.70
9
0.55
0.10
0.90
10
0.55
0.10
0.90
14
0.55
0.10
0.90
(2)体系中发生反应的化学方程式是______;
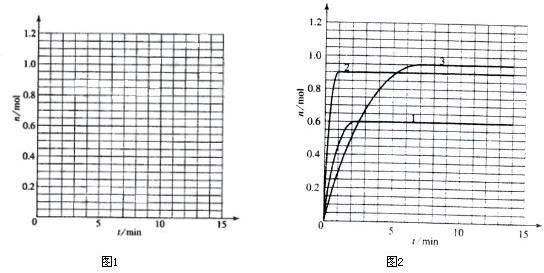
(3)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示)则曲线①、②、③所对应的实验条件改变分别是:①______②______?③______.
参考答案:(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时
本题解析:
本题难度:一般
4、填空题 (9分)对合成氨的研究具有很高的应用价值。在三个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表: 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:

(1)下列能说明该反应已达到平衡状态的是___________(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v (N2)正="3v" (H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t_________5min(填“>”、“<”或“=”)。
(3)乙中从反应开始到平衡时N2的化学反应速率为__________________。
(4)分析上表数据,下列关系正确的是_________(填字母序号)。
a.2c1=3mol·L—1 b.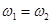 c. c.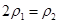
(5)该温度下,反应的化学平衡常数K=______________(用分数表示)。
参考答案:(1)c;(2)>;(3)0.2 mol/(L·min);(
本题解析:
试题分析:(1)a.容器内N2、H2、NH3的浓度之比为1:3:2不一定是平衡状态,错误;b.由v (N2)正="3v" (H2)逆知v (N2)正:v (H2)逆=3:1,不等于化学计量数之比,正、逆反应速率不相等,不是化学平衡状态,错误;c.容器内压强保持不变,已达平衡状态,正确;d.混合气体的密度不随反应的进行而变化,密度保持不变不能作为平衡标志,错误,选c;(2)分析表中数据知,甲容器中反应物的浓度比乙容器中反应物的浓度小,反应速率比乙容器慢,甲容器中达到平衡所需要的时间t>5min。(3)v(N2)=△c/△t="1" mol·L—1÷5min="0.2" mol/(L·min)。(4)分析上表数据知,乙容器中反应物的物质的量浓度为甲容器中反应物物质的量浓度的2倍,可看作甲容器的体积缩小1/2,相当于加压,平衡正向移动,则2c1<3mol·L—1 ,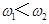 , ,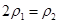 ,选c;(5)根据乙容器中的数据利用三行式计算,该温度下,反应的化学平衡常数K="[" NH3]2/[ N2][ H2]3=22/3×33=4/81。 ,选c;(5)根据乙容器中的数据利用三行式计算,该温度下,反应的化学平衡常数K="[" NH3]2/[ N2][ H2]3=22/3×33=4/81。
考点:考查化学平衡。
本题难度:困难
5、填空题 (16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)="0.9" mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
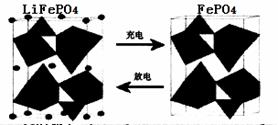
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
参考答案:Ⅰ.(1)B (2分) <
本题解析:
试题分析:Ⅰ.(1)A、反应前后气体的化学计量数之和不等,故容器总压强不随时间改变可作为判断是否达到化学平衡状态的依据,正确;B、总质量不变,体积也不变,故混合气体的密度不随时间变化而改变不能作为判断是否达到化学平衡状态的依据,错误;C、NO2为红棕色气体,N2O4为无色气体,故混合气体的颜色不随时间变化而改变可作为判断是否达到化学平衡状态的依据,正确;D、总质量不变,总物质的量在变,故反应混合气平均分子量不再改变可作为判断是否达到化学平衡状态的依据,正确。
(2)由图1可知,反应物为N2O4,生成物为NO2,反应进行到10min时,N2O4的物质的量变化为0.2mol/L×1L=0.2mol,共吸收热量11.38kJ,故反应1molN2O4共吸收热量11.38×5=56.9kJ,故该反应热化学 方程式为:N2O4(g)?2NO2(g),△H=+56.9kJ?mol?1。
(3)k= c2(NO2)/ c(N2O4) =0.62÷0.4=0.9。
(4)①恒容,充入一定量NO2,相当于增大压强,平衡逆向移动,新平衡后混合气体中NO2的体积分数减小,故W1>W2。
②30min时,c(NO2)=0.9mol/L,k=0.92 ÷c(N2O4) =0.9,c(N2O4)=0.9mol/L,20min-30min,N2O4的浓度增加了0.9-0.4=0.5mol/L,故NO2的浓度减少了1mol/L,则20min时,c(NO2)=1+0.9=1.9mol/L,可画出20 min后各物质的浓度随时间变化的曲线。
Ⅱ.(1)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4。
(2)计算得到,电解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,电路中转移了0.02mol e-,
阳极:2Cl- -2e- =Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L。
考点:本题考查图像的分析及绘画、化学平衡状态、化学平衡常数、热化学方程式、原电池原理及应用。
本题难度:困难
|