微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钢铁在潮湿环境中发生电化学腐蚀时,正极所发生的主要反应是(??)
A.Fe-2e-=Fe2+
B.2H++2e-=H2↑
C.2H2O+O2+4e-=4OH-
D.4OH--4e-=2H2O+O2↑
参考答案:C
本题解析:钢铁在潮湿的环境中发生电化学腐蚀有两种类型:析氢腐蚀和吸氧腐蚀。在水膜酸性较强时发生析氢腐蚀,水膜中性或弱酸性时发生吸氧腐蚀,两者负极反应相同,只是正极反应不同。在通常情况下,水膜为弱酸性或中性,主要发生的是吸氧腐蚀,故选择吸氧腐蚀的正极反应:2H2O+O2+4e-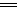 4OH-。
4OH-。
本题难度:一般
2、选择题
A.2H++2e-===H2
B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH-
D.Fe3++e-===Fe2+
参考答案:C
本题解析:钢铁发生吸氧腐蚀,正极上是氧气得电子被还原的反应:2H2O+O2+4e-===
4OH-。
本题难度:简单
3、选择题 被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是(???)
A.电池工作时,锌失去电子
B.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
C.电池工作时,电子由正极通过外电路流向负极
D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-
参考答案:C
本题解析:
试题分析:在纸质电池中镀锌一边为负极,镀二氧化锰一边为正极。电池工作时A.电池工作时,锌失去电子产生的Zn2+与OH-结合产生Zn(OH)2。正确。B.由方程式可看出:1摩尔Zn反应,转移电子2摩尔。即外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g。正确。C电池工作时,电子由负极通过外电路流向正极。错误。D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-,负极的电极反应式为:Zn-2e-+2OH -= Zn(OH)2.正确。
本题难度:一般
4、选择题 某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a 和 b 不连接时,铁片上会有金属铜析出
B.a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变
成浅绿色
D.a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
参考答案:D
本题解析:
试题分析:A.金属性:Fe>Cu,所以发生:Fe+Cu2+= Fe2++Cu。正确。B.该装置为原电池,铁作负极,铜作正极,电子由铁经导线流向Cu电极,在Cu电极上发生反应:Cu2++2e-=Cu。正确。C.通过A、B的分析发现:无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色。正确。D.a 和 b 分别连接直流电源正、负极,该装置为电解池,a 是阳极, b是阴极。Cu2+向负电荷多的铁电极方向移动。错误。
本题难度:一般
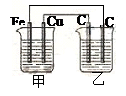
5、选择题 如图所示:甲为稀硫酸,乙为氯化铜溶液,电极材料用元素符号表示,则下列说法中正确的是
 91EXAm.org
91EXAm.org
A.甲装置将电能转变为化学能
B.乙装置中左边的碳棒上有红色金属析出
C.甲中Cu为阳极
D.甲中Fe的质量少了0.56g,乙中右边的碳棒质量增加了0.64g
参考答案:D
本题解析:
试题分析:铁和稀硫酸反应生成氢气,则根据装置图可知,甲是原电池,乙是电解池,A不正确。甲中铁是负极,铜是正极。所以乙装置中左边的碳棒是阳极,溶液中的氯离子放电,生成氯气,B不正确;C不正确,D正确,0.56g铁是0.01mol,失去0.02mol,则根据电子的得失守恒可知,乙中右边的碳棒析出铜的物质的量是0.01mol,质量是0.64g,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可,有利于培养学生的逻
本题难度:一般