微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+ B(g)  2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
A.B的转化率为25%
B.A的平均反应速率为0.15mol·(L·min)-1
C.恒温下达到平衡的标志是C和D的生成速率相等
D.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动
参考答案:B
本题解析:
试题分析:A根据反应方程式可知:没产生2mold C物质,消耗1mold B,则B的转化率为(1mol÷5mol) ×100%=20%.错误。B.V(C)=(2mol÷4L)÷5min=0.1mol/(L?min);V(C):V(D)=2:X=0.1:0.1,解得X="2" . V(A):V(D) = 3:X=3:2,V(A)="3V(D)" ÷2="0.15" mol/(L?min).正确。C. 由于C、D的系数相等,所以在任何时刻C和D的生成速率相等,这不能作为平衡的标志。错误。D. 降低温度
本题难度:一般
2、填空题 (12分) 恒容密闭容器中,某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号
| 浓度(mol/L)
| 时间(min)
|
0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 温
度
| 8000C
| 1.0
| 0.80
| O.64
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 8000C
| C2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 8000C
| C3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 8200C
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为????????????????????mol/(L·min)。
(2)在实验2,A的初始浓度c2=???????????mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是?????????????????????????????????。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3??????????υ1(填>、=、<=)
且c3?=???????????????mol/L。
(4)比较实验4和实验1,可推测该反应是??????????反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A  B+D的平衡常数=???????????????????????????,
B+D的平衡常数=???????????????????????????,
实验2中达到平衡时A的转化率=???????????????????????。
参考答案:(12分)(1)0.009 (2分) (2)1.0(1分)?
本题解析:(1)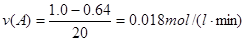 ;
;
则
(2)由于实验2平衡时A的浓度与实验1相同,互为等效平衡,即实验2,A的初始浓度c
本题难度:一般
3、填空题 (10分)计算填空:
(1)(2分)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置?????????????????????????。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_??????????????????????????????? aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol):?? 3????? 2?????????? 0
2s末物质的量浓度(mol/L): 0.9???? 0.8???????? 0.4
则①a=????????????????,b=???????????????????????;
②2S内B的反应速率=???????????????????????????。
(3)(2分) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式????????????????????????????????????????????????。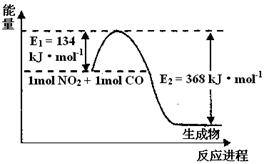
参考答案:(1)第三周期第ⅢA族(2分)
(2)①a=3(2分)
本题解析:(1)1.5mol氢气,共转移电子是1.5mol×2=3.0mol,所以该金属原子在反应中失去3铬电子。由于离子具有氖原子的电子层结构,因此金属的原子序数为13,即为铝元素,位于第三周期第ⅢA族。
(2)根据方程式可知A、B、C的浓度变化量分别是(mol/L)0.6、0.2、0.4,所以化学计量数之比为3︰1︰2,因此a=3,b=1。B的平均反应速率是 本题难度:简单
本题难度:简单
4、选择题 在一定温度下,2L密闭容器内,反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
该反应达到平衡状态的时间是( )
A.3?min
B.1?min
C.2?min
D.0?min
参考答案:当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度及物
本题解析:
本题难度:简单
5、填空题 (8分)
(1)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19,在该温度下的体积 2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充 固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应 为80%时,该反应
????(填“是”或“否”)达到化学平衡状态,若未达到,向???? (填“正反应”或“逆反应”) 方向进行。 (填“正反应”或“逆反应”) 方向进行。
(2)对于可逆反应:aA(g) +bB(g)  cC(g)+dD(g)?△H = a kJ·mol cC(g)+dD(g)?△H = a kJ·mol -1; -1;
若增大压强平衡向正反应方向移动,则a+b????c+d(填“>”或“<”);若升高温度,平衡向正反应方向移动,则a_______0(填“>”或“<”)
参考答案:(1)否?逆反应?(2)>?>
本题解析:略
本题难度:一般
|