微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
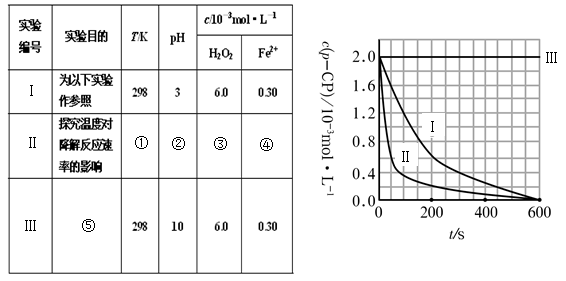
1、填空题 (16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
①??????????②??????????③??????????④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ????,以及300s时p-CP的降解率为??????????;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率?????????(填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时,?????????????????;
(3)可通过反应Fe3+ + SCN— ?Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K=??????。
?Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K=??????。
2、选择题 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?

?Y(g)+Z(s),以下能说明作为反应达到平衡标志的是( )
A.X的分解速率与Y的消耗速率相等
B.反应容器中压强不再变化
C.混合气体的密度不再变化
D.单位时间内生成lmolY的同时分解2molX
3、选择题 工业制硝酸的其中一步反应为氨的氧化,反应方程式为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol
氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
A.反应处于平衡状态时,c(NH3)?c(O2)=c(NO)?c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
4、填空题 (7分)某容积和温度不变的容器中,发生下列反应:
A(g)+2B(g) 2C(g)(正反应放热)
2C(g)(正反应放热)
回答下列问题:
(1)从A、B两气体充入容器至反应达到平衡状态,在此过程中,容器内压强____________(填“变大”“变小”或“不变”,下同),达到平衡后容器内压强___________________。
(2)使平衡体系的体积缩小,则气体A的浓度____________,气体C的物质的量___________________。
(3)化学反应达平衡状态后,加入适量的催化剂,则气体A的物质的量____________。
(4)若在平衡体系中,再充入一些气体A,则A的浓度____________,A的转化率________________________。
5、选择题 下列描述违背化学原理的是(???? )
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-= Cl2 ↑