微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A.70%
B.52.4%
C.47.6%
D.30%
参考答案:A
本题解析:
试题分析:由铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,则agFe、Al→agFe2O3,合金中铝的质量等于氧化铁中氧元素的质量,
则合金中铁的质量分数等于氧化铁中铁的质量分数,原合金中铁的质量分数为56×2/56×2+16×3×100%=70%。
本题难度:一般
2、选择题 为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中(???? )
A.通入氯气
B.加入NaOH
C.加入Fe
D.加入Cu
参考答案:C
本题解析:考查物质的除杂。由于不能引入新的杂质,所以AB不正确,C正确。铜不反应。答案选C。
本题难度:一般
3、实验题 为了“探究铁及其化合物的氧化性或还原性”.
(1)实验前同学预测:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:__?????????
(2)甲同学欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L -lFeCl2溶液、KSCN溶液、新制氯水.
①若计划在0.1 mol·L-l FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生反应的离子方程式为??????????????
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+反应的产物的存在以获取证据.你认为可选_____滴入小明所得的混合液中,并通过溶液出现___色的现象,证明该同学的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,该同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为该同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成_____.
②实际上Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:????????????????,相关反应的离子方程式:_____??????.
参考答案:(1)化合价介于0价与+3价之间(1分)
(2)①?
本题解析:
试题分析:(1)根据价态规律,处于中间价态的既有氧化性又有还原性,亚铁离子处于0和+3价之间,所以既有还原性又有氧化性
(2)①亚铁离子被氯气氧化成铁离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl—
②若亚铁离子被氧化成铁离子,则加入硫氰化钾溶液,溶液变红色,所以加入KSCN溶液,溶液呈红色,证明该同学的观点和实验方案都是正确的.
③锌粒逐渐变小说明锌与亚铁离子发生了置换反应,锌比铁活泼,铜不能置换铁,说明铁比铜活泼,三者的还原性由强至弱的顺序为Zn、Fe、Cu
本题难度:一般
4、选择题 类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观事实.下列各种类比推测的说法中正确的是( )
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强.
A.①③④
B.①②⑤
C.③④
D.③④⑤
参考答案:
①硫的氧化性比氧气、氯气弱,只能把金属氧化到低价.
本题解析:
本题难度:一般
5、选择题 能实现下列物质间直接转化的元素是
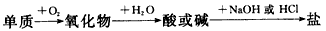
[???? ]
A.硅
B.硫
C.铜
D.铁
参考答案:B
本题解析:
本题难度:简单