微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有???????????????。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1:???????????;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
实验步骤
| 实验现象
| 实验结论
|
步骤1:向试管中加入少量固体产物,再加入足量?????????????????,充分振荡。
| 若溶液颜色明显改变,
且有红色固体生成。
| 有Fe存在。
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。
| ?
| ?
|
步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液,???????????????
??????????????????????????????????。
| ???????????????????????
??????????????????。
| 有FeO存在。
?
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为??????????????????????????????????????????????(写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式??????????????????????????????。
2、计算题
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是??????????????,
消耗的HNO3的物质的量是???????????????????????????
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L
(不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是???????mol。
为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是???????mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是??????????????mol。
3、填空题 铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
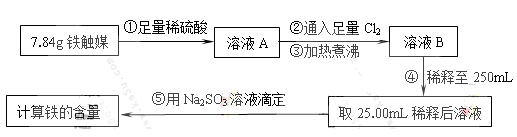
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸????????mL
(2)步骤②通入Cl2的目的是?????????????????(用离子方程式表示)
(3)步骤④后需用???????????(填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为?????????????。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式?????????????????????,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的????????????作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
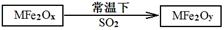
则可以判断x???????y,氧化性:MFe2Oy???????SO2(填“>”、“<”或“=”)
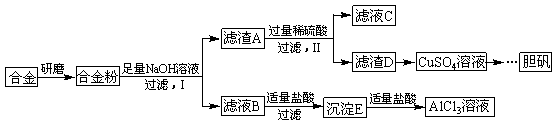
4、填空题 某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4?5H2O),其实验方案如下:
请回答下列问题:
(1)将合金研磨成合金粉的目的是?????????????????????????????????????????。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ:?????????????????????????????????????????????????;
Ⅱ:?????????????????????????????????????????????????。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为?????????????,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:????????????????????????????????????????????。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为?????????????????????????????????????。
5、填空题 氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
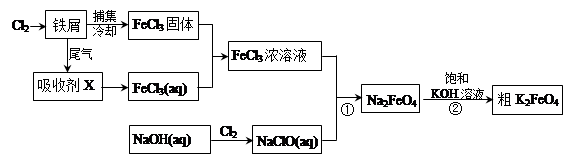
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________???????__________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为?????????????? ???。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示)???????????????????????。正确的检验方法是:取少量待测液,加入???????????????(写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因??????????????????????。 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因??????????????????????。
(5)将粗K2FeO4产品经重结晶、过滤、??????????、?????????,即得较纯净的K2FeO4。
|