有FeO存在。
?
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为??????????????????????????????????????????????(写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式??????????????????????????????。
参考答案:(1)CO、CO2(共2分;答对1个给1分)
(2)【
本题解析:
试题分析:(1)澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成,说明草酸亚铁分解的气体产物中含有CO2、CO;则碳元素既由+3价升高到+4价,又由+3价降低到+2价,由此可知FeC2O4 FeO+CO↑+CO2↑;(2)由于CO具有强还原性,可能将FeO还原为Fe,即FeO+CO FeO+CO↑+CO2↑;(2)由于CO具有强还原性,可能将FeO还原为Fe,即FeO+CO 本题难度:一般 本题难度:一般
2、计算题
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是??????????????,
消耗的HNO3的物质的量是???????????????????????????
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L
(不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是???????mol。
为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是???????mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是??????????????mol。
参考答案:
 本题解析:本题考查电子守恒和元素守恒,属中等难度。(1)n(O2)=ag/[64g·mol-1×2]= a/128mol 本题解析:本题考查电子守恒和元素守恒,属中等难度。(1)n(O2)=ag/[64g·mol-1×2]= a/128mol
n(HNO3)="2" n(Cu)= 2ag/64g·mol-1=a/32mol 。(2)利用氮元素守恒,可得消耗的HNO3的物质的量(a/32 +b/22.4)mol,再利用a g Cu失去的电子数与O2得到的电子数相等,可得消耗O2的物质的量是n(O2)=a/128mol。若直接通入NaOH溶液中气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量可利用电
本题难度:一般
3、填空题 铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
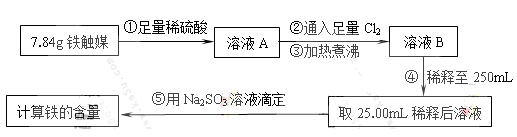
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸????????mL
(2)步骤②通入Cl2的目的是?????????????????(用离子方程式表示)
(3)步骤④后需用???????????(填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为?????????????。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式?????????????????????,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的????????????作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
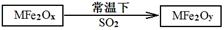
则可以判断x???????y,氧化性:MFe2Oy???????SO2(填“>”、“<”或“=”)
参考答案:Ⅰ.(1)8.2(2)2Fe2++Cl2=2Fe3++2Cl
本题解析:
试题分析:Ⅰ.在溶液稀释前后溶质的物质的量不变,利用稀释公式C1V1=C1V2可得1.50 mol·L-1×100m=18.4mol·L-1×Vml,解得V="8.2ml." (2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子,离子方程式是2Fe2++Cl2=2Fe3++2Cl-(3)氯化铁溶液显酸性要用移液管或酸式滴定管来量取,防止腐蚀碱式滴定管的橡胶管。(4)2Fe3++SO32-+H2O=2Fe2+SO42-+2H+可利用铁离子与亚硫酸根离子的关系求解得到原来的固体中含有铁的总物质的量为0
本题难度:一般
4、填空题 某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4?5H2O),其实验方案如下:
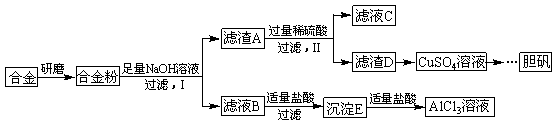
请回答下列问题:
(1)将合金研磨成合金粉的目的是?????????????????????????????????????????。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ:?????????????????????????????????????????????????;
Ⅱ:?????????????????????????????????????????????????。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为?????????????,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:????????????????????????????????????????????。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为?????????????????????????????????????。
参考答案:(1)增大反应物的接触面积,使反应速率加快(或使反应更充分)
本题解析:
试题分析:由流程图可知合金中加入NaOH溶液发生反应为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑故滤液B中含有Na[Al(OH)4]和NaOH,滤渣A中含有铁和铜,滤液B中加入适量盐酸生成的沉淀E为Al(OH)3
(1)增大反应物的接触面积,使反应速率加快(或使反应更充分)
(2)Ⅰ:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑??????Ⅱ:Fe+H2SO4=FeSO4+H2↑
 本题难度:一般 本题难度:一般
5、填空题 氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
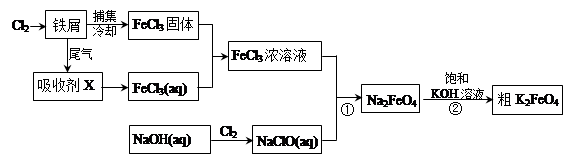
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________???????__________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为?????????????? ???。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示)???????????????????????。正确的检验方法是:取少量待测液,加入???????????????(写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因??????????????????????。 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因??????????????????????。
(5)将粗K2FeO4产品经重结晶、过滤、??????????、?????????,即得较纯净的K2FeO4。
参考答案:(1)①Fe3++3H2O 本题解析: 本题解析:
试题分析:(1)①氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故;②工业上常用FeCl3溶液腐蚀铜印刷线路板。是Fe3+氧化了Cu的缘故,FeCl3较强的氧化性。
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2。为检验吸收剂是否已完全转化为FeCl3溶液,用酸性高锰酸钾溶液不能验证,因为Cl-能被酸性高锰酸钾氧化为Cl2。Fe2+与铁氰化钾溶液或深蓝色沉淀产生,可用此显色反应来验证是否存在Fe2+。
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3
本题难度:一般
|