微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 N—H键能的含义是( )?
A.由N和H形成1 mol NH3所放出的热量?
B.把1 mol NH3的键全部拆开所吸收的热量?
C.拆开6.02×1023个N—H键所吸收的能量?
D.形成1个N—H键所放出的热量
参考答案:C
本题解析:本题考查键能的定义,键能是气态基态原子形成1 mol化学键释放的最低能量或断开l mol该键成为气态基态原子所吸收的最低能量。?
本题难度:一般
2、选择题 NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是(??)。
物质
| ①NaF
| ②NaI
| ③MgO
|
离子电荷数
| 1
| 1
| 2
|
离子间距离/10-10 m
| 2.31
| 3.18
| 2.10
?
A.①>②>③???????B.③>①>②
C.③>②>①???????D.②>①>③
参考答案:B
本题解析:NaF、NaI、MgO均为离子晶体,它们熔点高低由离子键强弱决定,而离子键的强弱与键长和离子电荷数有关,MgO中键长最短,离子电荷数最高,故离子键最强。
本题难度:一般
3、计算题 (8分)某离子晶体的晶胞结构如图所示。
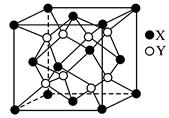
试求:
(1)晶体中每一个Y同时吸引着________________个X,每个X同时吸引着_____________个Y,该晶体的化学式是________________________________________________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为________________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为Na,则晶体中两个距离最近的X中心间的距离为________________cm。
参考答案:(1)4? 8? XY2或(Y2X)? (2)12? (3)
本题解析:(1)此结构虽不符合晶胞“无隙并置”,但仍可用此立方结构单元计算晶体组成。此立方单元中只有1个Y,且每个Y同时吸引4个X,而X处于顶点上为8个立方单元所共有,即每个X同时吸引8个Y。在每个该立方单元中含X ×4= ×4= 本题难度:一般 本题难度:一般
4、填空题 |
|
1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5°。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键------三个O原子均等地享有这个电子。请回答

(1)臭氧与氧气的关系是______________
(2)写出下列分子与O3分子的结构最相似的是______________
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有_________对孤对电子。
(4)O3分子是否为极性分子______________。(填是或否)
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
①_____PbS +_____O3 ====_______PbSO4 +______O2
②生成1mol O2的转移电子物质的量为__________mol。
参考答案:(1)同素异形体
(2)C?
(3)5
本题解析:
本题难度:一般
5、选择题 下列变化过程中,克服的是分子间作用力的是(??????)
A?烧碱溶于水??????????? B?氯化氢气体溶于水
C?二氧化碳变成干冰?????? D?加热碘化氢使其分解
参考答案:C
本题解析:烧碱溶于水克服离子键;氯化氢气体溶于水,克服共价键;二氧化碳变成干冰发生物理变化克服分子间作用力;碘化氢分解发生化学变化,克服共价键。选C。
本题难度:一般