微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作或实验所得出的结论一定正确的是???????????????????(???)
A.加热NH4 Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成
B.制备Fe(OH)2胶体时,应往沸水中逐滴加1mol·L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D.用托盘天平准确称取5. 85克NaCl
参考答案:B
本题解析:略
本题难度:简单
2、实验题 (15分)三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
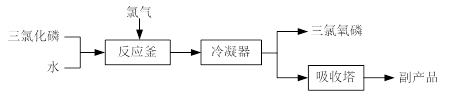
⑴氯化水解法生产三氯氧磷的化学方程式为?????。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是?????(选填字母),滴定终点的现象为?????。
a.FeCl2??????b.NH4Fe(SO4)2??????c.淀粉 ??????d.甲基橙
②实验过程中加入硝基苯的目的是?????,如无此操作所测Cl元素含量将会?????(填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是?????。
②下图是不同条件对磷的沉淀回收率的影响图像。

处理该厂废水最合适的工艺条件为?????(选填字母)。
a.调节pH=9???? b.调节pH=10??? c.反应时间30 min??? d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)=?????mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
参考答案:⑴PCl3+H2O+Cl2=POCl3+2HCl???? ⑵
本题解析:
试题分析:⑴氯化水解法生产三氯氧磷的反应物有PCl3、H2O、Cl2,生成物有POCl3,据原子守恒应该还有HCl生成,然后通过观察法将其配平。
⑵①当滴定达到终点时NH4SCN过量,可以用含有Fe3+的NH4Fe(SO4)2作指示剂,即溶液变为红色,半分钟内不褪色,即可确定滴定终点。
②由于AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;若无此操作,NH4SCN标准液用量偏多,使所测的氯元素的含量偏小;
⑶①在沉淀前先加入适量漂白粉使废水中的H3PO3氧化为PO43-,使其加入生石灰后能完全转化为磷酸的钙盐,达到较高的回收率。
②根据图1、2可确定pH=10、反应时间30 min时磷的沉淀回收率较高。
③根据Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-29,将c(PO43-)=4×10-7mol·L-1代入计算得c(Ca2+)=5×10-6mol·L-1。
考点;本题考查化学综合实验(条件的选择、滴定操作、误差分析、溶解度的计算等)。
本题难度:一般
3、简答题 某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
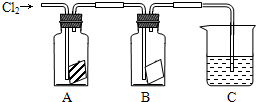
(1)通入Cl2一段时间后,A、B装置中,红色纸条的现象和结论为:
| 装置 | 现象 | 结论
A
______ |
潮湿的氯气______(填能或不能)使红色纸条褪色,因为反应生成的______具有漂白性
B
______
(2)C装置的作用是______
写出装置C中反应的化学方程式:______.
参考答案:(1)A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,则
本题解析:
本题难度:简单
4、实验题 (12分)实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
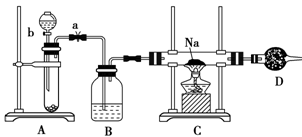
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气”或“无法确定”),判断理由是_________________。
(2)写出A装置中反应的化学方程式并标出电子得失情况:_____________。
(3)B装置中盛放的试剂是__________________,其作用是____________。
(4)C装置中观察到的现象是________________。
参考答案:(1)漏气 漏斗中的液体能全部流入试管说明试管中压强与外界相
本题解析:(1) 关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。说明装置漏气,原因是漏斗中的液体能全部流入试管说明试管中压强与外界相同
(2) A装置中反应的化学方程式并标出电子得失情况: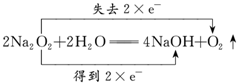
(3)B装置中盛放的试剂是浓硫酸,其作用是除去O2中的水蒸气
(4)C装置中观察到的钠燃烧的现象是:剧烈燃烧,发出黄光,有淡黄色物质生成
本题难度:简单
5、实验题 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是_________________,发生反应的化学方程式是___________________________
(2)B中加入的物质是_________________,其作用是:_________________
(3)实验时在C中观察到的现象是_________________,发生反应的化学方程式是_________________,
(4)实验时在D中观察到的现象是_________________,D中收集到的物质是_________________,检验该物质的方法和现象是______________________________。
参考答案:(1)固体NH4Cl和Ca(OH)2;2NH4Cl+Ca(O
本题解析:
本题难度:一般
|