微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学式既能表示物质的组成,又能表示物质的一个分子的是??(???)
A.NaOH
B.SiO2
C.C
D.CO2
参考答案:D
本题解析:
试题分析:构成物质的粒子有分子、原子、离子。分子是指能够独立存在并保持物质化学性质的一种微粒。
A项中NaOH由氢氧根离子和钠离子构成;B项中SiO2是原子晶体,平均一个硅原子与四个氧原子相连;C项中C由C原子构成;D项中的CO2是由分子构成的。每个选项都可以表示物质组成,能表示分子的就只有D,故本题选D。
点评:本题考查构成物质的粒子——分子、原子、离子,题目难度不大。
本题难度:简单
2、选择题 往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1
B.1.5mol·L-1
C.1.2mol·L-1
D.1.0mol·L-1
参考答案:C
本题解析:
试题分析:n(Cl2)=3.36L÷22.4L/mol=0.15mol由于离子的还原性:I-> Fe2+,若反应完成后溶液中有1/2的Fe2+被氧化成Fe3+,则I-反应完全。假设原碘化亚铁溶液的物质的量是x,则根据电子转移数目相等可得:2x+x/2=0.15×2,解得x=0.12mol,则c(FeI2)= 0.12mol÷0.1L=1.2mol/L。
考点:考查守恒方法在氧化还原反应计算中的应用的知识。
本题难度:一般
3、简答题 黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2?(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
已知:SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+
Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)接触室中发生反应的化学方程式是______.
(2)样品中FeS2的质量分数是(假设杂质不参加反应)______.
(3)每160gSO3气体与H2O化合放出260.6kJ的热量,该反应的热化学方程是______.
(4)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为______L,制得98%的硫酸质量为______t.
参考答案:(1)工业制备硫酸接触室中二氧化硫氧化为三氧化硫,反应方程式
本题解析:
本题难度:一般
4、选择题 下列是某学生总结的一些规律,其中正确的是(???? )
A.一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物
B.酸性氧化物都可以与强碱反应,生成盐和水
C.酸根离子中不可能含有金属元素
D.氧化物只能做氧化剂,不能做还原剂
参考答案:B
本题解析:A不正确,例如NO2和N2O4中氮元素的化合价都是+4价;C不正确,例如MnO4-等酸根;D不正确,例如SO2可以被氧化,作还原剂,答案选B。
本题难度:一般
5、填空题 (8分)对于实验室制取O2的反应:2KCLO3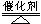 2KCL+3O2↑,其电子转移的方向和数目的标法有以下几种,你认为正确的是????????(填序号)
2KCL+3O2↑,其电子转移的方向和数目的标法有以下几种,你认为正确的是????????(填序号)



 该反应中,????????是氧化剂,????????是还原剂,MnO2是????????剂。
该反应中,????????是氧化剂,????????是还原剂,MnO2是????????剂。
参考答案: 本题解析:略
本题解析:略
本题难度:简单