微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 浓硝酸与下列物质反应,其中硝酸既表现酸性又表现氧化性的是
A.Cu
B.C?
C.Fe2O3
D.Na2CO3
参考答案:A
本题解析:Fe2O3、Na2CO3与浓硝酸反应无化合价的改变,属于非氧化还原反应;而C被硝酸氧化后,硝酸全部被还原为NO2,只表现氧化性;而铜与浓硝酸反应时,部分硝酸被还原为NO2,部分硝酸形成了硝酸铜,故答案为D;
本题难度:一般
2、选择题 下列关于资源综合利用和环境保护的化学方程式不正确的是( )
A.海水提溴时用SO2吸收Br2蒸气:SO2+Br2+2H2O=2HBr+H2SO4
B.将煤气化为可燃性气体:C(s)+H2O(g)
?高温?
.
?
CO(g)+H2(g)
C.用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3
D.燃煤时加入CaCO3脱硫:2CaCO3+2SO2+O2??△??
.
?
2CaSO4+2CO2
参考答案:A、二氧化硫可以和溴单质发生氧化还原反应生成氢溴酸和硫酸,即
本题解析:
本题难度:简单
3、选择题 往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1
B.1.5mol·L-1
C.1.2mol·L-1
D.1.0mol·L-1
参考答案:C
本题解析:
试题分析:n(Cl2)=3.36L÷22.4L/mol=0.15mol由于离子的还原性:I-> Fe2+,若反应完成后溶液中有1/2的Fe2+被氧化成Fe3+,则I-反应完全。假设原碘化亚铁溶液的物质的量是x,则根据电子转移数目相等可得:2x+x/2=0.15×2,解得x=0.12mol,则c(FeI2)= 0.12mol÷0.1L=1.2mol/L。
考点:考查守恒方法在氧化还原反应计算中的应用的知识。
本题难度:一般
4、选择题 m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是(?? )
A.(3m+n)mol
B.(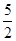 m+ m+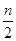 -3p)mol -3p)mol
C.(3m+n+2p)mol
D.( 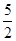 m+ m+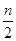 )mol )mol
参考答案:D
本题解析:在化学反应中原子是守恒的,燃烧消耗的氧气就相当于燃烧mmol乙烯和nmol氢气所需要的氧气。所以根据碳、氢原子的物质的量可知需要的氧气是( 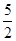 m+ m+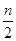 本题难度:一般 本题难度:一般
5、选择题 将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+)∶c(Fe3+)=3∶2,则参加反应的Fe和HNO3的物质的量之比为
A.1∶1
B.5∶16
C.2∶3
D.3∶2
参考答案:B
本题解析:
试题分析:同一溶液中,离子的浓度之比等于其物质的量之比,c(Fe2+):c(Fe3+)=3:2,所以该溶液中n(Fe2+):n(Fe3+)=3:2,设亚铁离子的物质的量为3xmol,则铁离子的物质的量为2xmol,根据化学式Fe(NO3)2、Fe(NO3)3知,起酸作用的硝酸的物质的量=3xmol×2+2xmol×3=12xmol;氧化还原反应中得失电子数相等,即铁失去的电子数等于硝酸根离子得到的电子数,设作氧化剂的硝酸根离子的物质的量为ymol,所以3xmol×2+2xmol×3=3ymol,y=4x,所以参加反应的硝酸的物质的量=12xmol+4xmol=16xmol,根据铁元素守恒知,参加反应的铁的物质的量=3xmol+2xmol,所以参加反应的Fe和HNO3的物质的量之比为5xmol:16xmol=5:16,故选B。
考点:考查氧化还原反应的计算
本题难度:一般
|
网站客服QQ: 960335752 - 14613519 - 791315772
|