微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在A+2B =3C+4D反应中,表示反应速率最快的数据是
[???? ]
A.v(A)=0.5 mol/(L·s)
B.v(B)=0.5 mol/(L·s)
C.v(C) =0.8 mol/(L·s)
D.v(D)=1.0 mol/(L·s)
参考答案:A
本题解析:
本题难度:简单
2、选择题 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
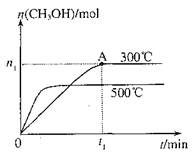
A.该反应的△H<0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0–t1 min内CH3OH的平均生成速率为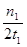 mol?L-1 min-1
mol?L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时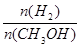 减小
减小
参考答案:AC
本题解析:
试题分析:读图,300℃变为500℃,平衡时甲醇的物质的量减小,说明平衡向逆反应方向移动,由于升高温度时平衡向吸热方向移动,则逆反应是吸热反应,因此推断正反应是放热反应,正反应的焓变小于0,故A正确;平衡常数是生成物平衡浓度幂之积与反应物平衡浓度幂之积的比值,升高温度平衡向逆反应方向移动,则生成物浓度减小、反应物浓度增大,因此推断升高温度时反应的平衡常数减小,故B错误;根据平均反应速率的定义式直接计算,v(CH3OH)=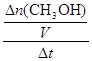 =
=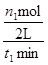 =
=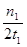 mol/(L?min),故C正确;A点的反应体系为300℃的平衡体系,因为正反应是放热反应,从300℃升高到500℃,平衡向逆反应方向移动,氢气的物质的量增大,甲醇的物质的量减小,则达到平衡时
mol/(L?min),故C正确;A点的反应体系为300℃的平衡体系,因为正反应是放热反应,从300℃升高到500℃,平衡向逆反应方向移动,氢气的物质的量增大,甲醇的物质的量减小,则达到平衡时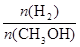 的值增大,故D错误。
的值增大,故D错误。
本题难度:简单
3、选择题 在反应:3H2+?N2 2NH3中,经过一段时间后,氨的浓度增加了0.6?mol/L,在此时间内用H2表示的平均反应速率为0.45?mol/(L
2NH3中,经过一段时间后,氨的浓度增加了0.6?mol/L,在此时间内用H2表示的平均反应速率为0.45?mol/(L s),则反应所经历的时间为 [???? ]
s),则反应所经历的时间为 [???? ]
A.?0.44?s????
B. 1s????
C. 0.33?s????
D. 2s
参考答案:D
本题解析:
本题难度:简单
4、填空题 (12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为?????????????。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) ???????????。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 ????????????(填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 ?????????(填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较??????????????。
A.无法确定
B.⑷一定大于⑴
C.⑷一定等于⑴
D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则a、b、c应该满足的关系为 ???????????????????????。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 ?????????????。
参考答案:(共12分)(1)0.03mol/(L?min)???(2)
本题解析:
试题分析:(1)???2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
起始量(mol) 3????????? 0??? 0
转化量(mol) 2x???????? x??? 3x
平衡量(mol)3-2x?????? x??? 3x
平衡时测得容器内的压强为起始时的1.2倍
则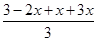 =1.2
=1.2
解得x=0.3mol
所以平衡时Y的物质的量浓度=0.3mol÷2L=0.15mol/L
因此Y的物质的量浓度变化表示的速率为0.15mol/L÷5min=0.03 mol/(L?min)
(2)在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s),则根据反应速率之比是相应的化学计量数之比可知,如果都用X表示反应速率,则分别是3.5mol/(L?min)、4mol/(L?min)、3.0mol/(L?min)、4.5mol/(L?min)。温度越高反应速率越大,所以根据反应速率可知,温度由高到低的顺序是(填序号)丁>乙>甲>丙。
(3)若向达到(1)的平衡体系中充入氩气,由于其它物质的浓度不变,则平衡不移动;若向达到(1)的平衡体系中移走部分混合气体,导致生成物浓度降低,则平衡向右移动。
(4)由于该反应是体积增大的可逆反应,且反应物只有一种,所以平衡后再次通入X气体,相当于增大压强,平衡向逆反应方向移动,所以若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较⑷一定小于⑴,答案选D。
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则根据方程式将生成物Y和Z恰好可以完全转化为X即可,所以a、b、c应该满足的关系为c=3b且a≥0。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则根据方程式将生成物Y和Z恰好可以完全转化为X,使X的物质的量等于3mol即可,所以c的最大值是4.5mol。由于平衡时c的物质的量是0.9mol,所以要满足起始时维持化学反应向逆反应方向进行,则c必须大于0.9mol,因此c的取值范围是0.9<c≤4.5。
本题难度:困难
5、填空题 (1)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)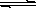 Cu2+(aq)+2OH-(aq),常温下其Ksp=
Cu2+(aq)+2OH-(aq),常温下其Ksp=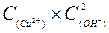 =
=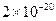 ??。
??。
①某硫酸铜溶液里Cu2+浓度0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液,使溶液中OH-浓度为 。
(2)用标准的NaOH滴定未知浓度的盐酸,盐酸装在锥形瓶中,并滴入酚酞为指示剂,NaOH溶液装在?????????(填仪器名称)中。造成测定结果偏高的原因可能是?????????????????。
A.未用标准液润洗,就装入标准液
B.滴定前读数时仰视,滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用待测液润洗
D.滴定过程中,锥形瓶中有数滴溶液溅出
E. 终点时,溶液显浅红色,且半分钟内没有褪去
参考答案:⑴① 5 ;????②? 本题解析:略
本题解析:略
本题难度:简单