微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应.为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为a?L.反应的化学方程式是______,样品中铝的质量分数是______(用含a的表达式表示).
(2)若取同质量的样品,在高温下使其恰好反应,则a=______L;该反应的化学方程式是______.
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为b?L,该气体与(1)中所得气体的体积比a:b______.
参考答案:(1)铝和NaOH反应的化学方程式为2Al+2NaOH+2H
本题解析:
本题难度:一般
2、选择题 下列关于铝合金的说法中错误的是?????????????????????????????????????????(???)
A.镁铝合金在冷的浓H2SO4中钝化
B.镁铝合金抗氧化,但能被烧碱腐蚀
C.镁铝合金是一种混合物,它比纯铝的熔点低
D.高温铝液易被氧化,铝合金应在熔剂层覆盖下熔炼
参考答案:A
本题解析:略
本题难度:简单
3、选择题 铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的硫酸和NaOH物质的量之比为
A.1:1
B.3:1
C.3:2
D.1:3
参考答案:C
本题解析:
试题分析:反应的有关方程式为:铝与盐酸:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;假设生成的氢气的物质的量为3mol,根据方程式计算NaOH、HCl的物质的量,从而计算出氢氧化钠和氯化氢物质的量的之比。设生成的氢气的物质的量为3mol,则:
2Al+6HCl=2AlCl3+3H2↑
6mol??????3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol?????????3mol
本题难度:一般
4、选择题 将钠、铝混合物(质量A1g)投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体7.84L.向溶液中逐滴加入浓度为2mol?L-1的H2SO4溶液,至100ml时白色沉淀达到最大量.继续滴入H2SO4溶液,当加入H2SO4溶液的体积为xml时沉淀恰好消失.将所得溶液蒸干灼烧得固体A2g.下列关系式中不正确的是( )
A.沉淀达到最大量时溶液中的溶质为Na2SO4、NaHSO4
B.x=75ml
C.A1=11.9
D.白色沉淀最大量为7.8g
参考答案:A.将钠、铝混合物投入水中,发生的反应为2Na+2H2O═2
本题解析:
本题难度:简单
5、填空题 某化学兴趣小组模拟工业上从铝土矿(主要成分是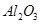 ,含
,含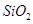 、
、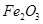 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下:
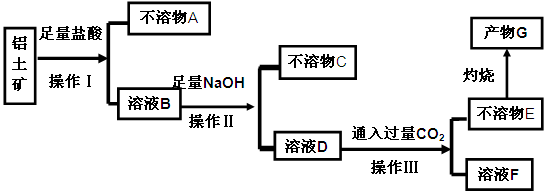
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为???????????。
(2)验证溶液B中是否含有Fe3+的方法:????????????????????????????????????????????。
(3)不溶物A是????????(填化学式),写出D→E反应的离子方程式??????????????????????。
(4)说出溶液F中含碳元素溶质的一种用途???????????????????????????????????。
参考答案:(1)过滤(2分)
(2)取少量溶液B于试管中,加入少
本题解析:
试题分析:加入盐酸后,铝土矿中的Al2O3、Fe2O3、MgO能和盐酸反应,而SiO2不能溶解,即不溶物A是SiO2,操作Ⅰ是过滤;所得的滤液B有氯化铝、氯化铁、氯化镁以及过量的盐酸,向其中加过量的烧碱,所得不溶物C为Mg(OH)2? Fe(OH)3,操作Ⅱ也是过滤, 所得滤液D的主要成分为偏铝酸钠,通入过量CO2的化学方程式为NaA1O2+CO2+H2O=Al(OH)3 ↓+NaHCO3,操作Ⅲ也是过滤,将它们分离,不溶物E为Al(OH)3,灼烧后生成产物G为Al2O3,(1)操作Ⅰ、Ⅱ、Ⅲ的名
本题难度:一般