微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是[???? ]
A.单质都是由同种元素组成的,只含一种元素的物质一定是纯净物
B.金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
参考答案:D
本题解析:
本题难度:简单
2、选择题 在含0.3mol AlCl3的氯化铝溶液中加入200 mL烧碱溶液,能生成0.1mol沉淀,则加入烧碱溶液物质的量浓度可能是:①1.5 mol·L-1?②4.5 mol·L-1?③5.5 mol·L-1?????( )
A.②
B.①
C.③
D.①、③
参考答案:D
本题解析:
试题分析:通过发生的化学反应进行计算
假设烧碱少量,发生的化学反应只有Al3++3OH-═Al(OH)3↓,生成0.1mol沉淀,烧碱的物质的量为0.3mol,浓度为1.5 mol·L-1。
假设烧碱过量,发生的化学反应有Al3++3OH-═Al(OH)3↓和Al(OH)3+OH-═AlO2-+2H2O,生成0.1mol沉淀,烧碱的物质的量为0.3mol为1.1mol,浓度为5.5 mol·L-1。
故选D。
点评:本题考查铝离子与碱的反应,明确碱的物质的量对发生的化学反应
本题难度:一般
3、填空题 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
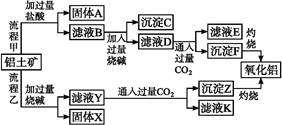
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。?
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。?
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。?
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。?
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。?
参考答案:(1)Al2O3+6H+ 本题解析:(1)能与HCl反应生成Al3+的物质应为铝土矿中的Al2O3。(2)Al2O3溶于NaOH中生成NaAlO2。(3)利用题目中给出的信息——Na2Al2Si2O8是沉淀,铝土矿中Al2O3、SiO2与NaOH反应生成的NaAlO2、Na2SiO3反应生成Na2Al2Si2O8沉淀。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。
本题解析:(1)能与HCl反应生成Al3+的物质应为铝土矿中的Al2O3。(2)Al2O3溶于NaOH中生成NaAlO2。(3)利用题目中给出的信息——Na2Al2Si2O8是沉淀,铝土矿中Al2O3、SiO2与NaOH反应生成的NaAlO2、Na2SiO3反应生成Na2Al2Si2O8沉淀。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。
本题难度:一般
4、选择题 铝元素是金属元素,某同学认为铝也有一定的非金属性。下列描述中,你认为能支持该同学观点的是
A.铝片能与盐酸反应生成氢气
B.氢氧化铝能溶于强碱溶液
C.氯化铝溶液显酸性
D.铝能发生铝热反应
参考答案:B
本题解析:略
本题难度:简单
5、选择题 将a g镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L 的氢氧化钠溶液,得到的沉淀量最大,沉淀质量为(a+1.7) g,则下列说法不正确的是:
A.镁铝合金与盐酸反应时转移的电子数为0.1NA
B.x = 2y
C.沉淀的是Mg(OH)2和Al(OH)3的混合物
D.2x = y
参考答案:B
本题解析:a g镁铝合金,反应后变为氢氧化镁、氢氧化铝沉淀质量为(a+1.7) g,增加的质量为1.7g,为氢氧根离子的质量,故n(OH-)=0.1mol,所以,镁铝合金与盐酸反应时转移的电子数为0.1NA,A 正确;
当沉淀量最大时,n(HCl)与n(NaOH)相等,2x = y,故D正确,B 错误。
得到的沉淀量最大时,肯定是Mg(OH)2和Al(OH)3的混合物,C 正确。
本题难度:一般