本题解析:
本题难度:一般
2、填空题 铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是????(填标号)。
A.升高温度
B.增大压强
C.充入一定量CO
D.再加一些铁粉
(2)图1装置发生反应的离子方程式为?????????????????????????????????????????。

(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。

① 电源的M端为?????极,甲烧杯中铁电极的电极反应为????????????????????。
② 乙烧杯中电解反应的化学方程式为?????????????????????????????????????。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为??????mL 。
参考答案:(1)① 本题解析:
本题解析:
试题分析:(1)①Fe与Fe2O3为固体,不列入平衡常数表达式。
②升高温度,平衡向右移动,c(CO)/c(CO2) 增大,A项正确;,因为反应前后气体系数相等,增大压强、充入一定量CO, c(CO)/c(CO2)不变,故B项、C项不正确;再加铁粉,平衡不移动,D项不正确。
(3)①石墨电极附近变红,H2O电离出的H+放电,使OH?浓度增大,该电极为阴极,所以N极为负极,M极为正极;甲烧杯中铁电极为阳极,Fe失电子:Fe - 2e-=Fe2+。
②电解CuSO4溶液生成Cu、O2、H2SO4,方程式为:2CuSO4+2H2O 2Cu +O2↑ +2H2SO4。
2Cu +O2↑ +2H2SO4。
③Cu电极:Cu2++2e?=Cu,n(e?)=2n(Cu2+)=2×0.64g÷64g/mol=0.02mol,串联电路中通过的电量相等,甲烧杯中石墨电极产生H2:2H++2e?=H2↑V(H2)=1/2n(e?)×22.4L/mol=0.224L=224ml。
本题难度:一般
3、简答题 I、恒温下,将amolN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a=______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量______.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=______.
(4)原混合气体中,a:b=______.
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=______.
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
II、若向体积不变的密闭容器中充入2molN2和6molH2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),平衡时混合气共7mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c=______.
(2)若a=0.7,b=2.1,则:
①c=______.
②这时反应向______进行,因为:______.
③若要维持反应开始向该反应方向进行,c的范围是______.
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是______.
参考答案:(1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质
本题解析:
本题难度:一般
4、选择题 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是[???? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025 Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
参考答案:D
本题解析:
本题难度:简单
5、填空题 (1)(4分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)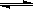 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:

①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)(3分)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)(3分)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为???????????????????。
(4)(3分)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)=??????????????mol·L-1。
参考答案:(16分)
(1)(4分)<?? 60%
本题解析:
试题分析::(1)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0。②令平衡时CO的物质的量变化为nmol,则:
1/3Fe2O3(s)+CO(g)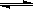 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
开始(mol):1 ???????????????????????1
变化(mol):n ???????????????????????n
平衡(mol):1-n???????????????????? 1+n
所以(1+n)/(1-n) =4,解得n=0.6,
所以n(CO)=0.6mol÷1mol×100%=60%。
(2)依据盐类的规律“谁弱谁水解,谁强显谁性”,MR是弱酸强碱盐,故水解反应的离子方程式为M++H2O MOH+H+。
MOH+H+。
(3)四种溶液中由水电离产生的c(H+)分别为:10-14、10-13、10-12、10-14,之比为1:10:100:1。
(4)电离常数Ka(HF)=c(H+)×c(F-)÷c(HF) =3.6×10-4,c(HF)=" 0.1" mol·L-1,c(H+)=c(F-),故c(H+)=6×10-3。
(5)(3分)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L。在此温度下5×10—5mol/LBa(OH)2溶液的pH=?????。
(5)在温度t ℃时,离子积常数K= c(OH-)×c(H+)=10-3 (mol/L)×10-8 (mol/L) =10-11 (mol/L)2。5×10—5mol/LBa(OH)2溶液中,c(OH-)=10-4 mol/L,根据K= c(OH-)×c(H+),得c(H+)= 10-7 mol/L,pH=7。
点评:本题考查的是综合的知识,题目难度中,注意基础知识的学习、掌握及应用。
本题难度:一般