微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
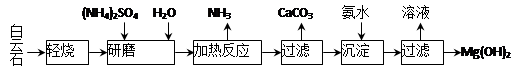
(1)研磨的作用是???????????????????。
(2)该工艺中可循环使用的物质是?????????????、??????????(写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是???????????????????????????????????????????????。
(4)加热反应的离子方程式为???????????????????????????????????????????????????。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
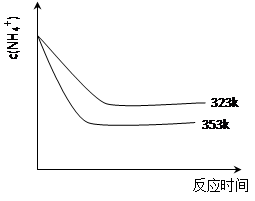
②由图可知,随着温度升高:?????????????????。
参考答案:(1)增大固体的表面积,加快反应速率,增大原料利用率
本题解析:(1)研磨的作用主要从对反应速率和原料的利用率角度分析,可以增大固体的表面积,加快反应速率,增大原料利用率;
(2)图中加热反应时放出氨气,而沉淀反应时加入氨水,因此可以将氨气循环利用,图中研磨时需要加入硫酸铵和水,而过滤时得到的溶液中含有硫酸铵,因此可以将硫酸铵循环利用;
(3)依题意,轻烧时只有碳酸镁分解,而碳酸钙不分解,由于二者的分解反应都是吸热反应,因此可以减少能耗、减少CO2的排放等(即节能、低碳);
(4)加热反应的反应物为轻烧产生的氧化镁、研磨时加入的硫酸铵溶液,生成物是氨气,由此推断加热时溶液中发生复分解反应,根据电解质拆分原则、电荷和原子守恒原理,则该反应为MgO+2NH4+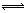 Mg2++2NH3↑+H2O;
Mg2++2NH3↑+H2O;
(5)读图可知,随着温度的升高,反应速率加快,平衡向正反应方向移动,则达到平衡的时间缩短,平衡时铵根离子浓度减小,由此可以确定373K时曲线的起点、平衡点或拐点,从而可以画出曲线。
本题难度:一般
2、选择题 已知一定温度下合成氨反应:N2 +3 H2 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 (?? )
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 (?? )
参考答案:A.Q2 =2Q1???????????B.Q1 < 0.5
本题解析:N2 +3 H2 2 NH3??ΔH=-92.4 kJ/mol在恒温、恒压的密闭容器①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1<92.4kJ< Q2 .②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2 < 184.8 kJ
2 NH3??ΔH=-92.4 kJ/mol在恒温、恒压的密闭容器①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1<92.4kJ< Q2 .②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2 < 184.8 kJ
本题难度:一般
3、选择题 下列关于化学反应限度的叙述中正确的是(?????)
A.化学反应的限度都相同
B.可以通过改变反应条件控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应限度
D.当一个化学反应在一定条件下达到限度时反应即停止
参考答案:B
本题解析:
试题分析:A.化学反应的限度都是在一定条件下的限度,条件不同,同一化学反应的限度也不同。错误。B.当可逆反应达到一定条件下的化学平衡时,正反应速率与逆反应速率相等。若可以通过改变反应条件,使正反应速率与逆反应速率不再相等,反应就可以向正反应方向或逆反应方向移动,从而可控制化学反应的限度。正确。C.通过延长化学反应的时间只能改变反应化学反应速率,但是不可以改变化学反应限度。错误。D.当一个化学反应在一定条件下达到限度时反应仍然在进行,只不过单位时间内的消耗浓度与产生的浓度相等,任何物质的浓度不再发生改变。错误。
本题难度:一般
4、选择题 下列图示与对应的叙述相符的是
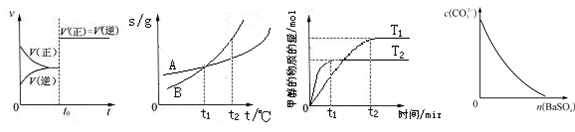
图6??????????????????图7????????????????图8?????????????????图9
A.图6表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂,也可能是改变压强
B.图7表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图8表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图9表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化
参考答案:A
本题解析:
试题分析:B项:没有新的物质加入,虽溶解度有变化,但质量分数没有改变,故错;C项:T1、T2哪个大哪个小不知,无法判断,故错;D项:BaSO4比BaCO3难溶,CO32-浓度不会不变,故错。故选A。
点评:本题考查较为综合,以图象的形成考查化学平衡移动问题以及元素化合物知识,题目难度中等,注意把握反应的原理。
本题难度:简单
5、简答题 反应N2+3H2?2NH3在恒温恒容密闭容器中进行,如果起始时c(N2)=4mol/L,C(H2)=8mol/L,经过5min反应达到平衡时有10%的N2转化,求:
(1)5min内NH3的平均反应速率是多少?
(2)平衡时NH3占总体积百分数是多少?
(3)平衡时和起始时的压强比为多少?
参考答案:依据化学平衡三段式列式计算,经过5min反应达到平衡时有10
本题解析:
本题难度:一般