微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知298 K时下列物质的溶度积(单位略)。
?
| CH3COOAg
| AgCl
| Ag2CrO4
| Ag2S
|
Ksp
| 2.3×10-3
| 1.77×10-10
| 1.12×10-12
| 6.7×10-15
?
下列说法正确的是
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的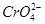 和Cl-的溶液中慢慢滴入AgNO3溶液时, 和Cl-的溶液中慢慢滴入AgNO3溶液时,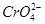 先沉淀 先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
2、填空题 (14 分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
????????????????????????????????????????????????????????????????????????。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
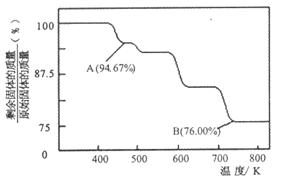
①A 点时剩余固体的成分是??????(填化学式)。B 点时剩余固体的成分是???????(填化学式)
②从开始加热到 750K时总反应方程式为????????????????????。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为?????????mol·L-1。
3、选择题 已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×10-36mol2·L-2。 下列说法正确的是
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl?2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
4、选择题 石灰乳中存在下列平衡:Ca(OH)2(s)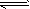 Ca2+(aq) +2OH-(aq),加入少量下列固体物质,可使Ca(OH)2减少的是 [???? ] Ca2+(aq) +2OH-(aq),加入少量下列固体物质,可使Ca(OH)2减少的是 [???? ]
A. Na2CO3
B. NaCl
C. NaOH
D. CaCl2
5、填空题 已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.
①温度升高时,Ksp______(填“增大”、“减小”或“不变”下同).
②滴加少量浓盐酸,c(Ca2+)______,原因是______(用文字和离子方程式说明).
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______.若某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于______(已知Ksp[Cu(OH)2]=2.0×10-20).
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈______性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO32-水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)______.
|