微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K=????????????????,SO2的平衡转化率=?????????????????。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K=????????????????,SO2的平衡转化率=?????????????????。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有??????????(填字母)
A.升高温度
B.降低温度
C.增大压强
D.减小压强 (E)加入催化剂 (G)移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是______________________。
2、填空题 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l)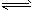 NaCl(l)+K(g)-Q 该反应的平衡常数可表示为:K=C(K)各物质的沸点与压强的关系见下表。
NaCl(l)+K(g)-Q 该反应的平衡常数可表示为:K=C(K)各物质的沸点与压强的关系见下表。

(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为________,而反应的最高温度应低于_________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______________。
(3)常压下,当反应温度升高至900℃时,该反应的平衡常数可表示为:K=_______________。
3、选择题 下列表述中正确的是 [???? ]
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)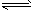 2SO3(g) ΔH=-Q kJ·mol-1(Q>0),则将2mol SO2(g)和1mol O2
2SO3(g) ΔH=-Q kJ·mol-1(Q>0),则将2mol SO2(g)和1mol O2
(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
4、填空题 (2014届浙江省嘉兴市高三教学测试(二)理综化学试卷)
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 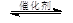 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)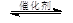 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)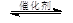 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表: