微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图,回答下列问题:
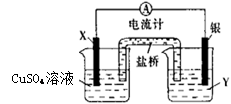
(1)电极X的材料是 ,电解质溶液Y是 。
(2)银电极为电池的 极。
(3)盐桥中阳离子向 移动(填“左 ”或“右”)。
(4)外电路中电子是从 (填电极材料名称,下同)电极流向 电极。
参考答案:(1)铜;AgNO3溶液(2)正(3)右(4)铜,银
本题解析:
试题分析:根据总反应式可知,图中一个简单的铜-银原电池构造,所以铜失电子做负极,X电极材料为金属铜;银离子得到电子被还原,银做正极,相应电解质溶液为AgNO3溶液;由于左边有大量Cu2+ 生成,所以为保持左边溶液电中性,会吸引盐桥中的阴离子向左移动;而相反右边电极Y有大量Ag单质析出,Ag+ 大量减少,会使盐桥中阳离子往右移动,而由铜失去的电子从外电路转移给银电极。
考点:本题考查的是原电池原理知识。
本题难度:一般
2、填空题 (9分)(1)X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示,则四种金属的活泼性由强到弱的顺序为______??_____
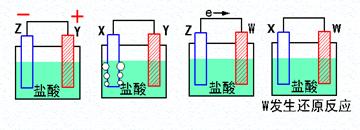
(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极????????????????????????????????、负极??????????????????????????
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式???????????????????????????
参考答案:(1)?Z〉Y〉X〉W???? 3分????????????
本题解析:考查原电池的应用及电极反应式的书写。
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据第1个可知Z的金属性强于Y的,第2个可知Y的金属性强于X的,第3个可知Z强于W的,第4个可知X强于W的,所以四种金属的活泼性由强到弱的顺序为Z〉Y〉X〉W。
(2)铝比铜活泼,铝是负极,铜是正极,电极反应式分别是2Al- 6e- =2Al3+、6H+ + 6e- =3H2↑。
(3)氢
本题难度:一般
3、填空题 (9分)(1)X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示,则四种金属的活泼性由强到弱的顺序为______ _____
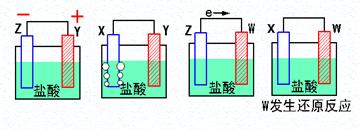
(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极 、负极
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式
参考答案:(1) Z〉Y〉X〉W &#
本题解析:考查原电池的应用及电极反应式的书写。
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据第1个可知Z的金属性强于Y的,第2个可知Y的金属性强于X的,第3个可知Z强于W的,第4个可知X强于W的,所以四种金属的活泼性由强到弱的顺序为Z〉Y〉X〉W。
(2)铝比铜活泼,铝是负极,铜是正极,电极反应式分别是2Al- 6e- =2Al3+、6H+ + 6e- =3H2↑。
(3)氢氧燃料电池中氧气在正极通入,所以反应式为O2 + 4 e- + 2H2O = 4OH-。
本题难度:一般
4、填空题 (1)图1装置发生反应的离子方程式为 。
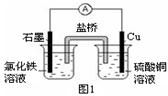
(2)图2装置中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。

① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式 ,
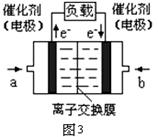
甲醇燃料电池的总反应化学方程式 。
参考答案:(14分)
(1)2Fe3+ + Cu = 2Fe2+
本题解析:
试题分析:(1)Fe3+与Cu发生氧化还原反应,离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+。
(2)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-
本题难度:一般
5、选择题 下列有关锌锰干电池的说法中正确的是( )
A.锌外壳是负极,石墨碳棒是正极材料
B.在外电路中电子从碳棒流向锌外壳
C.电流从锌流到碳棒上
D.在电池内部阳离子从碳棒向锌片移动
参考答案:A、阳极原电池原理分析,失电子的做负极,在正极上得到电子发生
本题解析:
本题难度:简单