微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 汽车尾气的主要成分为CO2及CO、 NOx(NO和NO2的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOx发生反应大 部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟汽车尾气处理中CO和NOx的反应,并测量反应后混合气体的组成。(已知HCOOH CO↑+H2O) 试回答下列问题:
CO↑+H2O) 试回答下列问题:
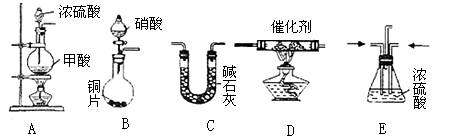
(1)仪器的连接顺序为 ( )→( )→( )→收集气体
( )→( )→( )→收集气体
(2)E装置的作用是________、________。
(3)写出D中NOx与CO反应的化学方程式________。
(4)若B容器中生成的NOx为NO,写出该反应的化学方程式,并标出电子转移的方向和数目___________。
(5)若通入的NOx为NO,C装置增重8.8 g,收集到的气体在标准状况下为 4. 48 L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为____________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环 境的影响,这种说法是否正确并阐述理由:______________。
参考答案:(1)(E)→(D)→(C)收集气体
(2)干燥混合气
本题解析:
本题难度:一般
2、填空题 为测定硫酸亚铁铵晶体【(NH4)2Fe(SO4)2?xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/LKMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、______、转移、洗涤并转移、______、摇匀.
(2)用______滴定管盛放KMnO4溶液.
(3)当滴入最后一滴KMnO4溶液,出现______,即到达滴定终点.反应的离子方程式:______
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.05
21.04
2
25.00
1.50
24.50
3
25.00
0.20
20.21
实验测得该晶体中铁的质量分数为______.(保留两位小数)
(5)根据步骤二填空:
①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将______.(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将______(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.
A、滴定管内液面的变化B、锥形瓶内溶液颜色的变化
④滴定后俯视读数,测得样品中铁的质量分数将______(填“偏高”、“偏低”或“无影响”).
参考答案:(1)配制溶液需要称量、溶解、转移、洗涤并转移、定容、摇匀等
本题解析:
本题难度:简单
3、选择题 根据实验目的判断下列实验操作或装置正确的是( )
A.
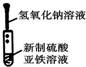
制备氢氧化亚铁并观察其颜色
B.
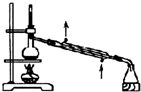
石油的分馏实验
C.
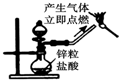
制备并检验氢气的可燃性
D.
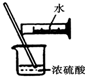
浓硫酸稀释
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列实验操作正确且能达到预期目的是
A.①②⑥
B.④⑤⑥
C.⑥⑦⑧
D.③④⑥
参考答案:D
本题解析:分析:①烧杯中的水不能装满;
②不能在容量瓶中溶解药品;
③苯酚可与NaOH反应;
④MgCl2、AlCl3和CuCl2溶液分别与NaOH反应现象不同;
⑤二氧化硫与酸性高锰酸钾反应表现为还原性;
⑥可通过单质之间的置换反应证明氧化性强弱;
⑦应注意防止酸液飞溅;
⑧溶液浓度应相同才具有可比性.
解答:①钠与水反应剧烈,烧杯中的水不能装满,防止实验事故的发生,故①错误;
②容量瓶只能用于配制溶液,不能在容量瓶中溶解药品,故②错误;
③苯酚可与NaOH反应,生成溶液水的苯酚钠,难挥发,然后用蒸馏的方法分离,故③正确;
④MgCl2、AlCl3和CuCl2溶液分别与NaOH反应,现象分别为白色沉淀,先沉淀后溶解,生成蓝色沉淀,可鉴别,故④正确;
⑤二氧化硫与酸性高锰酸钾反应表现为还原性,故⑤错误;
⑥将氯气通入溴化钠溶液,生成单质溴,可证明氧化性强弱,故⑥正确;
⑦配制浓硫酸和浓硝酸的混合酸,应将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌,故⑦错误;
⑧应在浓度相同的前提下加入催化剂,故⑧错误.
故选D.
点评:本题考查化学实验基本操作,题目难度中等,注意把握相关物质的性质为解答该题的关键,学习中注意基础知识的积累.
本题难度:一般
5、简答题 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(1)此消毒液可吸收空气中的CO2生成NaHCO3而变质.写出化学反应方程式?.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分可以判断消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol?L-1?KI-淀粉溶液、1.0mol?L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案.
| ????所加试剂 | ????????????预期现象和结论
试管A中加足量①?;
试管B中加1%品红溶液;
试管C中加②?.
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质;
③?则消毒液未变质;
④?则消毒液完全变质.
(3)用滴定法测定消毒液中NaClO的浓度.实验步骤如下:
①量取25.00mL消毒液放入锥形瓶中,加入过量的a?mol?L-1Na2SO3溶液b?mL;
②滴定分析.将c?mol?L-1的酸性KMnO4溶液装入?(填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据.重复滴定实验2次,平均消耗酸性KMnO4溶液v?mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为?mol?L-1(用含a、b、c、v的代数式表示).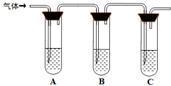
参考答案:
本题解析:
本题难度:一般
|
|