微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为______.判断是否达到恒重的标准是______.
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有______.
②滴定时选择的指示剂为甲基橙.当溶液______时,说明达到了滴定终点.
③为减少偶然误差,通常的处理办法是______.
④滴定时若锥形瓶内有少量液体溅出,则测定结果______.(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果______.
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1?g;③称量W2?g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3?g.该方案样品中纯碱的质量分数为______(用代数式表示).上图中装置A的作用是______.装置C的作用是______.有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”).改进措施可以是______.
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是______.(选填序号)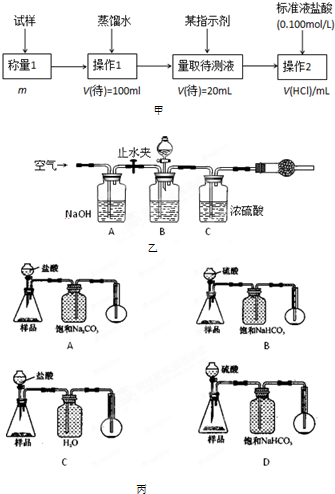
2、简答题 某白色粉末可能含有K2SO4、NH4Cl、NaCl.请设计合理实验探究该白色粉末的组成.
限选实验仪器与试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、1mol?L-1硫酸、1mol?L-1硝酸、1mol?L-1盐酸、2mol?L-1NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水.
完成以下实验探究过程:
(1)提出假设:
根据题意,该白色粉末的组成有______种可能的情况.
(2)设计实验方案
基于该粉末中上述三种盐均存在这一假设,设计出实验方案(不要在答题卡上作答).
(3)根据②的实验方案,叙述实验操作、预期现象和结论.
| 实验操作 | 预期现象和结论
步骤1:______
______
步骤2:______
______
步骤3:______
______
步骤4:______
______
…
______
3、选择题 下列实验能够成功的是( )
A.用新制Cu(OH)2(必要时加热)可鉴别CH2O、HCOOH、CH3OH三物质的溶液
B.将乙醇加热到170℃可制得乙烯
C.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯
D.用饱和的Na2CO3溶液除去CO2中的HCl
4、填空题 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
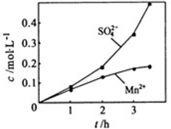
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳作用______.
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是______.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①______;②______;③检验SO42-是否被洗涤除去;④______;⑤低于100℃干燥.
Ⅱ锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于
250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,
用0.01100mol?L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是______.
(2)计算合金中Cu的质量分数______.
5、实验题 茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
【查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;Ca、A1、Fe完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3;pH≥5.5;Fe(OH)3:pH≥4.1)
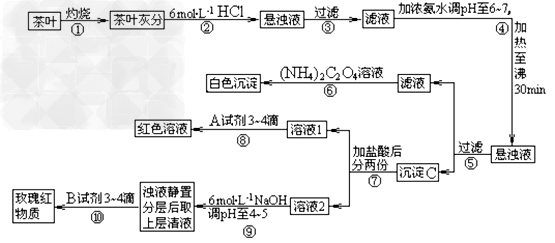
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是_____________。
(2)写出检验Ca2+的离子方程式_______________?。
(3)写出沉淀C所含主要物质的化学式_____________________。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式___________________。
(5)步骤⑨的作用是_____________?,猜测步骤⑩的目的是___________________。
|